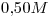Examen Parcial - 05. Química (CBC) - 2006
Fecha: 1er Parcial, 2do Cuatrimestre 2006
Enunciado
Punto I
Una muestra de 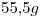 de
de 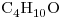 líquido, ocupa un volumen de
líquido, ocupa un volumen de 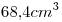 a
a 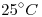 y
y 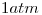 .
.
Dato: 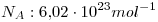 .
.
1) Calcular el volumen molar del compuesto en dichas condiciones.
2) Calcular el número de moléculas contenidas en la muestra.
Punto II
3) Indicar el número de neutrones presentes en el núcleo de un átomo que tiene un número másico igual a 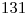 y puede formar un anión monovalente isoelectrónico con el quinto gas noble.
y puede formar un anión monovalente isoelectrónico con el quinto gas noble.
4) Ordenar de mayor a menor las energías de ionización de los siguientes elementos, identificando a cada uno con su símbolo:
a)el que tiene una CEE 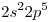
b)el ubicado en el Período 3, Grupo V A
c)el tercer alcalino.
5) Escribir la estructura de Lewis del anión de la oxosal cuya fórmula es 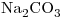 .
.
6) Indicar si la molécula de  es polar o no polar. Justificar considerando la geometría de la molécula y la polaridad de sus enlaces.
es polar o no polar. Justificar considerando la geometría de la molécula y la polaridad de sus enlaces.
7) Nombrar segun IUPAC el compuesto cuya fórmula es 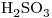 .
.
8) Escribir la fórmula del cloruro férrico.
Punto III
Dados los siguientes compuestos orgánicos:
a)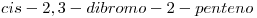
b)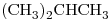
c)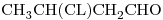
d)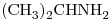
e)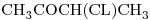
9) Escribir la fórmula semidesarrollada del compuesto “a)”.
10) Nombrar según las recomendaciones de la IUPAC al compuesto “c)”.
11) ¿Cuáles de los compuestos dados son isómeros entre sí y que tipo de isomería (cadena, posición, funcional) presentan?
12) Seleccionar entre los compuestos dados uno que sea ópticamente activo. Escribir su fórmula semidesarrollada marcando con asterisco/s el/los átomo/s de carbono quiral/es.
13) Indicar entre los compuestos “b)” y “d)” cuál tiene mayor punto de ebullición. Justificar, teniendo en cuenta todas las fuerzas intermoleculares actuantes.
Punto IV
14) ¿Qué masa de soluto se necesita para preparar 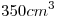 de una solución de
de una solución de 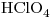
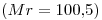
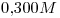 ?
?
15) Una solución de una determinada sustancia tiene una concentración 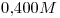 y
y 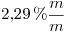 , siendo su densidad
, siendo su densidad 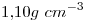 . Calcular la masa molecular relativa de la sustancia.
. Calcular la masa molecular relativa de la sustancia.
16) Ordenar las siguientes soluciones en forma decreciente de concentración de iones nitrato:
a)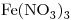
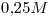
b)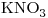
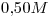
c)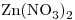
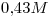 .
.
Resolución
Punto I
1)
(Debido a que es un líquido NO se puede utilizar la ecuación de los gases para encontrar la relación volumen-masa)
De la fórmula del compuesto 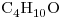 se puede calcular:
se puede calcular: 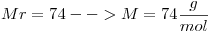


Volumen Molar=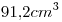
2)
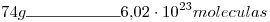

Número de moléculas en la muestra=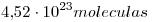
Punto II
3)
El elemento 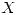 forma un anión monovalente:
forma un anión monovalente: 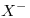 .
.
El quinto gas noble es: 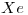 (Xenón), su número atómico es 54, por lo que tiene 54 electrones y 54 protones (es un átomo neutro).
(Xenón), su número atómico es 54, por lo que tiene 54 electrones y 54 protones (es un átomo neutro).
Como el anión monovalente 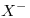 es isoelectrónico con el
es isoelectrónico con el 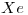 , tiene igual cantidad de electrones:
, tiene igual cantidad de electrones: 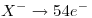
El anión 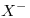 tiene un electrón más que su cantidad de protones:
tiene un electrón más que su cantidad de protones: 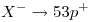
El número de protones NO cambia cuando el átomo se convierte en anión 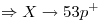
El número másico es dato: 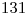
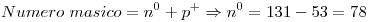
4)
Los elementos a ordenar son:
a) 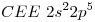
Máximo nivel de energía= 2 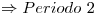
La configuración termina en orbital “p” 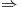 Elemento Representativo
Elemento Representativo 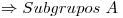
Por ser representativo, el número de grupo es la suma de los electrones de la CEE 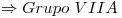
El elemneto en el Período 2, Grupo VII A es el 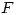 (Fluor).
(Fluor).
b) El elemento ubicado en el período 3, grupo VA es el  (Fósforo).
(Fósforo).
c) Los alcalinos pertenecen al Grupo I A, el primero se encuentra en el Período 2 (el Hidrógeno no es alcalino), el tercero se encuetra en el período 4.
El elemento en el período 4, grupo IA es el  (Potasio).
(Potasio).
La energía de ionización disminuye dentro de un Grupo hacia períodos mayores (Z aumenta) y dentro de un Período aumenta hacia la derecha (Z aumenta).
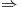 a)>b)>c)
a)>b)>c)
5)
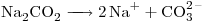
 El anión es:
El anión es: 
Y la estructura de Lewis queda:
6)
La Lewis del  es la siguiente:
es la siguiente:
Las uniones H-C y C-N son polares, debido a la diferencia de electronegatividad entre los elementos.
El Carbono está rodeado por dos pares de electrones (la unión covalente tripe actúa como un par), estos se repelen y la Geometría Electrónica será la que menor repulsión genere. Esta es la Geometría electrónica LINEAR:
Como todos los pares de electrones están compartidos, entonces la Geometría Molecular es LINEAL:
Los átomos unidos al carbono son distintos, por lo que los momentos dipolares de las uniones son diferentes. Y siendo su Geometría Molecular LINEAL, dichos momentos no se compensan.
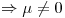 Molécula POLAR
Molécula POLAR
7)
Este compuesto, 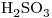 , es un Oxoácido. En el cual el Hidrógeno actúa con número de oxidación
, es un Oxoácido. En el cual el Hidrógeno actúa con número de oxidación 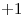 , el Oxígeno con
, el Oxígeno con 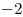 y por lo tanto el Azufre con
y por lo tanto el Azufre con 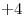 .
.
El nombre del compuesto es: Sulfato (IV) de Hidrógeno
8)
El Cloruro Férrico es una Sal Binaria ó Sal NO Oxigenada, compuesta por 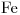 y
y 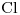 . El Cloro actúa con numero de oxidación
. El Cloro actúa con numero de oxidación 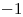 (el único negativo que presenta), y el Hierro actúa con número de oxidación
(el único negativo que presenta), y el Hierro actúa con número de oxidación 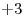 , indicado por la terminación
, indicado por la terminación 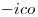 .
.
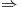
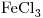
Punto III
9)
El compuesto 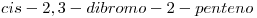 , presenta dos átomos de Bromo en las posiciones 2 y 3, por ser
, presenta dos átomos de Bromo en las posiciones 2 y 3, por ser 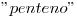 tiene 5 carbonos (pent-) y el doble enlace (por alqueno) se encuentra en la posición 2.
tiene 5 carbonos (pent-) y el doble enlace (por alqueno) se encuentra en la posición 2.
Hasta ahí iría quedando:
Con los Hidrógenos: 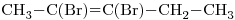
Desarrolada, con la isomería geométrica “cis-”:
10)
El compuesto: 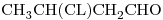 tiene por grupos funcionales al aldehído (
tiene por grupos funcionales al aldehído (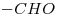 ) y al Cloro (
) y al Cloro (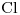 )
)
El aldehído ( terminación 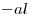 ) es más importante que el grupo halógeno, por lo que dará nombre al compuesto; y el cloro se nombrará como sustituyente.
) es más importante que el grupo halógeno, por lo que dará nombre al compuesto; y el cloro se nombrará como sustituyente.
Tiene 4 átomos de Carbono en línea, y todas las uniones son simples. Entonces, corresponde a 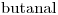
El carbono del grupo 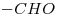 es el 1º, el grupo cloro está en el carbono 3.
es el 1º, el grupo cloro está en el carbono 3.
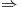
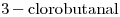
11)
Fórmulas moleculares:
a) 
b) 
c) 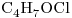
d) 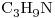
e) 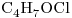
Los únicos dos con igual fórmula molecular son el “c)” y el “e)”, entonces sólo estos dos son isómeros entre sí.
Sus grupos funcionales:
c) 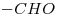 y
y 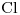
e) 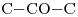 y
y 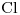
Como los grupos funcionales son distintos, son Isómeros funcionales.
12)
Los compuestos opticamente activos, es decir, que presentan un Carbono unido a cuatro átomos o grupos de átomos distintos, son el “c)” y el “e)”.
Sus fórmulas con indicación del Carbono quiral quedan:
c) 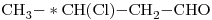
e) 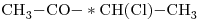
13)
El compuesto “b)” está formado sólo por átomos de Carbono e Hidrógeno, los momentos dipolares se anulan y, por lo tanto, la molécula queda NO polar. El compuesto “d)” tiene un átomo de Nitrógeno, que es más electronegativo que el Carbono, por lo que la molécula es Polar.
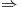 “b)”: Fuerzas intermoleculares de London.
“b)”: Fuerzas intermoleculares de London.
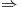 “d)”: Fuerzas intermoleculares de London, Dipolo-Dipolo, Puente de Hidrógeno (
“d)”: Fuerzas intermoleculares de London, Dipolo-Dipolo, Puente de Hidrógeno ( )
)
Para el compuesto “b)”: 
Para el compuesto “d)”: 
Por ser lo Mr similares, las Fuerzas de London también lo serán. Por lo que la presencia de los otros dos tipos de fuerzas hacen que el Punto de Ebullición del compuesto “d)” > Punto de Ebullición del compuesto “b)“
Punto IV
14)
Se quiere obtener 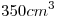 de solución de concentración
de solución de concentración 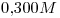 , entonces:
, entonces:


La masa molar del Soluto es 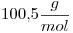 , entonces:
, entonces:


La masa de soluto necesaria es 10.55g
15)
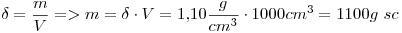
La solución es 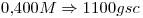 contienen
contienen 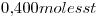
Además, la solución es 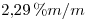 , entonces:
, entonces:


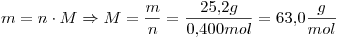
Mr y M coinciden en número.
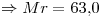
16)
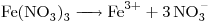
Concentración molar del ión  el triple de la de la sal
el triple de la de la sal
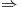 a)
a)![<ce>[NO3-]</ce> <ce>[NO3-]</ce>](lib/plugins/ce/images/4b9e7467020844012d081932baa417ac4e24d11d_0.png)
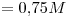
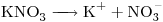
Concentración molar del ión  igual a la de la sal
igual a la de la sal
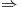 b)
b)![<ce>[NO3-]</ce> <ce>[NO3-]</ce>](lib/plugins/ce/images/4b9e7467020844012d081932baa417ac4e24d11d_0.png)
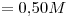
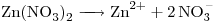
Concentración molar del ión  el doble de la de la sal
el doble de la de la sal
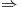 c)
c)![<ce>[NO3-]</ce> <ce>[NO3-]</ce>](lib/plugins/ce/images/4b9e7467020844012d081932baa417ac4e24d11d_0.png)
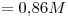
Concentración de  : c)
: c)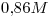 > a)
> a)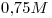 > b)
> b)