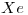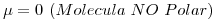Examen Parcial - 05. Química (CBC) - 2006
Fecha: 1er Parcial, 2do Cuatrimestre 2006
Enunciado
Punto I
Una muestra de 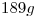 de una sustancia pura al estado líquido, ocupa un volumen de
de una sustancia pura al estado líquido, ocupa un volumen de 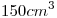 a
a 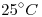 y
y 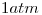 . El volumen molar de la sustancia en dichas condiciones es de
. El volumen molar de la sustancia en dichas condiciones es de 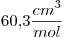 .
.
Dato: 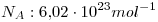 .
.
1) Calcular la masa molar de la sustancia.
2) Calcular el número de moléculas contenidas en la muestra.
Punto II
3) Escribir la CEE del átomo que puede formar un anión divalente isoelectrónico con otro átomo que tiene las siguientes características: número másico 85 y 49 neutrones.
4) Ordenar de menor a mayor las energías de ionización de los siguientes elementos, identificando a cada uno con su símbolo:
a) el que tiene una CEE 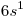
b) el ubicado en el período 5, grupo VIA
c) el quinto gas noble.
5) Escribir la Lewis del anión de la oxosal cuya fórmula es 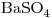
6) Indicar si la molécula de 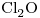 es polar o no polar. Justificar considerando la geometría de la molécula y la polaridad de sus enlaces.
es polar o no polar. Justificar considerando la geometría de la molécula y la polaridad de sus enlaces.
7) Nombrar según la nomenclatura tradicional el compuesto cuya fórmula es 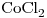 .
.
8) Escribir la fórmula del 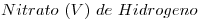
Punto III
Dados los siguientes compuestos orgánicos:
a) 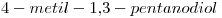
b) 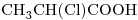
c) 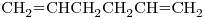
d) 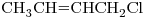
e)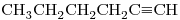
9) Escribir la fórmula semidesarrollada del compuesto “a)”.
10) Nombrar según las recomendaciones de la IUPAC al compuesto “c)”
11) ¿Cuáles de los compuestos dados son isómeros entre sí y qué tipo de isomería (cadena, posición, funcional) presentan?
12) Seleccionar entre los compuestos dados uno que sea ópticamente activo. Escribir su fórmula semidesarrollada marcando con asterisco/s el/los átomo/s de carbono quiral/es.
13) Indicar entre los compuestos “b)” y “d)” cuál tiene mayor punto de ebullición. Justificar, teniendo en cuenta todas las fuerzas intermoleculares actuantes.
Punto IV
14) Se tiene una solución de 
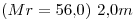 . Indicar la masa de soluto que hay en
. Indicar la masa de soluto que hay en 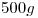 de solución.
de solución.
15) Una solución de 
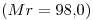 de concentración
de concentración 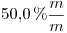 , tiene una densidad de
, tiene una densidad de 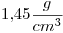 . Calcular su molaridad.
. Calcular su molaridad.
16) Ordenar las siguientes soluciones en forma creciente de concentración de iones litio:
a) 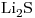

b) 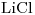
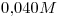
c) 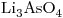
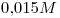
Resolución
Punto I
Respuestas:
1) 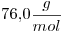
2) 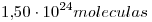
Punto II
Punto III
Respuestas:
9) 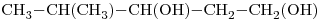
10) 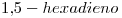
11) “c)” y “e)” isomería funcional.
12) 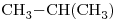 -*
-*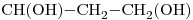
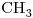 -*
-*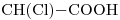
13) “b)” > “d)“
Punto IV
Respuestas:
14) 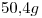
15) 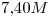
16) “a)” < “b)” < “c)“

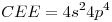
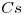 < b)
< b)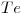 < c)
< c)