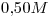Examen Parcial - 05. Química (CBC) - 2006
Fecha: 1er Parcial, 2do Cuatrimestre 2006
Enunciado
Punto I
Una muestra de 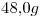 de una sustancia pura al estado líquido, ocupa un volumen de
de una sustancia pura al estado líquido, ocupa un volumen de 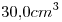 a
a 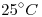 y
y 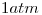 . El volumen molar de la sustancia en dichas condiciones es de
. El volumen molar de la sustancia en dichas condiciones es de 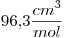 .
.
Dato: 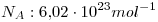 .
.
1) Calcular la masa molar de la sustancia.
2) Calcular el número de moléculas contenidas en la muestra.
Punto II
3) Indicar el número másico de un átomo que tiene 50 neutrones en su núcleo y puede formar un catión monovalente isoelectrónico con el cuarto gas noble.
4) Ordenar de menor a mayor los radios atómicos de los siguientes elementos, identificando a cada uno con su símbolo:
a)el que tiene una CEE 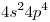
b)el ubicado en el Período 3, Grupo VII A
c)el tercer alcalino térreo.
5) Escribir la estructura de Lewis del anión de la oxosal cuya fórmula es 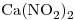 .
.
6) Indicar si la molécula de 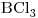 es polar o no polar. Justificar copnsiderando la geometría de la molécula y la polaridad de sus enlaces.
es polar o no polar. Justificar copnsiderando la geometría de la molécula y la polaridad de sus enlaces.
7) Nombrar segun IUPAC el compuesto cuya fórmula es 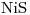 .
.
8) Escribir la fórmula del ácido perclórico.
Punto III
Dados los siguientes compuestos orgánicos:
a)propanato de metilo
b)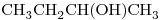
c)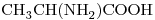
d)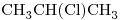
e)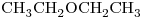
9) Escribir la fórmula semidesarrollada del compuesto “a)”.
10) Nombrar según las recomendaciones de la IUPAC al compuesto “c)”.
11) ¿Cuáles de los compuestos dados son isómeros entre sí y que tipo de isomería (cadena, posición, funcional) presenta?
12) Seleccionar entre los compuestos dados uno que sea ópticamente activo. Escribir su fórmula semidesarrollada marcando con asterisco/s el/los átomo/s de carbono quiral/es.
13) Indicar entre los compuestos “b)” y “d)” cuál tiene mayor punto de ebullición. Justificar, teniendo en cuenta todas las fuerzas intermoleculares actuantes.
Punto IV
14) Se preparan 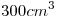 de solución acuosa de
de solución acuosa de 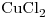
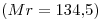
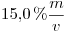 . Calcular el número de moles de sal disueltos.
. Calcular el número de moles de sal disueltos.
15) Una solución de 
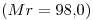 cuya densidad es
cuya densidad es 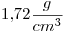 tiene una concentración
tiene una concentración 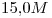 . Indicar su concentración expresada en
. Indicar su concentración expresada en 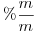 .
.
16) Ordenar las siguientes soluciones en forma decreciente de concentración de iones potasio:
a)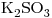
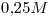
b)
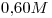
c)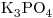
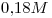 .
.
Resolución
Punto I
1)
Como las condiciones para el dato del Volumen molar son las mismas que para los datos de Masa y Volumen, se puede plantear:




Masa Molar= 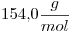
2)
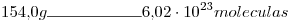

Nº móleculas en esa muestra=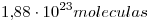
Punto II
3)
Cuarto gas noble: 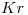 —>
—> 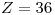 ⇒
⇒ 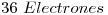
Catión Monovalente 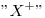 isoelectrónico con
isoelectrónico con 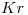 ⇒
⇒ 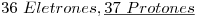
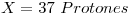
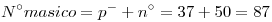
Número Másico=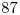
4)
Elementos:
a) CEE 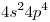 ⇒ Pertenece al Período 4, Grupo VIA ⇒
⇒ Pertenece al Período 4, Grupo VIA ⇒ 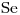
b) Período 3, Grupo VIIA ⇒ 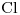
c)Tercer Alcalino Terreo⇒ Pertence al Grupo IIA, Período 4 ⇒ 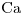
Radio atómico aumenta:
en un Grupo, cuando Z aumenta
en un Período, cuando Z disminuye
b) 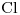
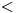 a)
a) 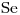
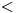 c)
c) 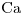
5)
Anión de la oxosal 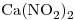 :
: 
Estructura de Lewis:
6)
La estructura de Lewis del compuesto 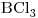 es:
es:
Su geometría molecular será:
Todos los átomos unidos al Boro son iguales ⇒ Momentos dipolares de todas las uniones son iguales ⇒ se compensan⇒ Momento dipolar Resultante CERO.
 Molécula NO POLAR
Molécula NO POLAR
7)
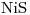 . Sulfuro de Níquel (II)
. Sulfuro de Níquel (II)
8)
Ácido perclórico. 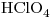
Punto III
9)
Propanoato de metilo
……..ato de …….ilo corresponde a un éster.
Su estructura es 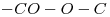
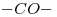 : ……ato
: ……ato 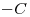 : ……ilo
: ……ilo
“prop”: 3 átomos de Carbono “met”: 1 átomo de Carbono
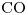 tiene enlace doble
tiene enlace doble 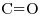 , no lleva átomos de Hidrógeno
, no lleva átomos de Hidrógeno
El resto de los Carbonos sí se completan con Hidrógeno, hasta obtener 4 pares de electrones compartidos.
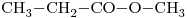
10)
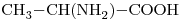
Grupos funcionales: 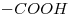 (ácido carboxílico);
(ácido carboxílico);  (grupo amino)ºº
El grupo “ácido carboxílico es el más importante, da nombre al compuesto, por medio de la palabra “ácido” y la terminación -oico.
(grupo amino)ºº
El grupo “ácido carboxílico es el más importante, da nombre al compuesto, por medio de la palabra “ácido” y la terminación -oico.
Tiene 3 átomos de Carbono: “prop-”. Todas las uniones 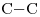 son simples ⇒ ácido propanoico.
son simples ⇒ ácido propanoico.
El grupo amino se debe incorporar como sustituyente.
El carbono de grupo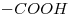 es el 1. El grupo amino se encuentra en el 2º carbono ⇒
es el 1. El grupo amino se encuentra en el 2º carbono ⇒ 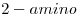
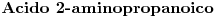
11)
Los compuestos isómeros poseen igual Fórmula Molecular, con algún cambio en sus estructuras.
Fórmulas Moleculares:
a)propanato de metilo (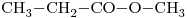 ):
): 
b)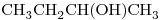 :
: 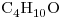
c)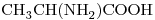 :
: 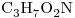
d)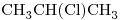 :
: 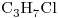
e)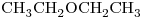 :
: 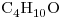
Los que presentan igual Fórmula Molecular son el “b)” y el “e)“, por lo que son isómeros entre sí.
Segun sus grupos funcionales: el “b)” corresponde a un alcohol, y el “e)” a un éter.
Por ello son Isómeros Funcionales.
12)
Los compuestos con actividad óptica son aquellos que tienen por o menos un carbono quiral, es decir, un carbono unido a cuatro átomos o grupos de átomos distintos.
En este caso son los compuestos:
b) 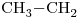

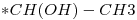
c) 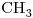

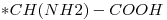
13)
b)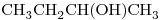 : Molécula Polar (Por átomo de O)
: Molécula Polar (Por átomo de O)
d)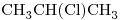 : Molécula Polar (Por átomo de Cl)
: Molécula Polar (Por átomo de Cl)
Ambos presentan Fuerzas de London y Dipolo-Dipolo
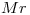 (
(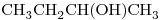 )
)
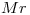 (
(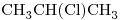 )
)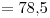
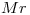 similares ⇒ intensidad Fuerzas de London similares.
similares ⇒ intensidad Fuerzas de London similares.
El compuesto “b)” Posee un átomo de Oxígeno unido a uno de Hidrógeno, por lo que posee Fuerza de Puente de Hidrógeno, la cual suele ser más intensa que las otras dos.
Punto de ebullición de “b)” > “d)“
Punto IV
14)



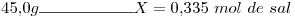
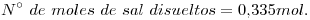
15)
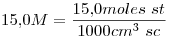
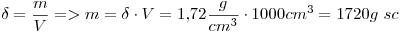
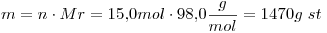


La solución es 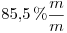
16)
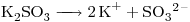
Concentración molar del ión 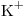 el doble de la de la sal
el doble de la de la sal
⇒ a)![<ce>[K+]</ce> <ce>[K+]</ce>](lib/plugins/ce/images/e1c33d67982e8f9c97b6e5d67e3d3d9983bd6218_0.png)
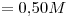
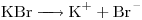
Concentración molar del ión 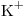 igual a la de la sal
igual a la de la sal
⇒ b)![<ce>[K+]</ce> <ce>[K+]</ce>](lib/plugins/ce/images/e1c33d67982e8f9c97b6e5d67e3d3d9983bd6218_0.png)
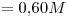
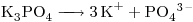
Concentración molar del ión 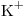 el triple de la de la sal
el triple de la de la sal
⇒ c)![<ce>[K+]</ce> <ce>[K+]</ce>](lib/plugins/ce/images/e1c33d67982e8f9c97b6e5d67e3d3d9983bd6218_0.png)
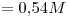
Concentración de 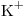 : b)
: b)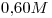 > c)
> c)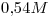 > a)
> a)