Tabla de Contenidos
Parcial segunda parte - 76.45. Termodinámica de los Procesos
Cátedra: Única
Fecha: 1° Oportunidad - (2º Cuatrimestre 2007)
Día: 23/11/2007
Punto 1
Los datos experimentales del calor de mezclado para la mezcla liquida n-octanol (1) /n-decano (2) pueden ajustarse mediante la curva ![<tex>\mathit{H=x _1 \cdot x _2[A+B(x _1 \cdot x _2)]}</tex> <tex>\mathit{H=x _1 \cdot x _2[A+B(x _1 \cdot x _2)]}</tex>](lib/plugins/latex/images/9619d1ba0bb8e8e01b73bad95b63377b764ea0a9_0.png)
Con 
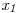 : fracción molar de n-octanol
: fracción molar de n-octanol ![<tex>\mathit{T: [K] \; y \; H:[J/mol]}</tex> <tex>\mathit{T: [K] \; y \; H:[J/mol]}</tex>](lib/plugins/latex/images/a8b75ab82d2f446710bbcb6c429ea7310b519ff8_0.png)
- a) Calcule los valores de la entalpía molar para el n-octanol y el n-decano puros a 300K. ¿qué puede decir de los valores que obtuvo?
- b) Calcule los valores de la entalpía molar parcial para el n-octanol y el n-decano, en la mezcla liquida con concentración 50% molar de n-octanol a 300K.
- c) Se tienen dos soluciones (Sa y Sb) con concentraciones molares en n-octanol del 20% (Sa) y 90% (Sb) respectivamente. Ambas soluciones fluyen en estado estacionario dentro de una cámara de mezclado a 27°C y con una relación de flujos molares:
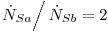
- calcule el flujo de calor por mol de solución que abandona el mezclador [J/mol Sc] necesario para mantener la temperatura de la misma en 300K (
 )
) - ¿Durante el mezclado debería agregarse o quitarse calor?
- d) Grafique
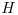 vs.
vs. 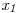 a 300K y muestre la relación entre los valores graficados y los calculados en (b).
a 300K y muestre la relación entre los valores graficados y los calculados en (b). - e) Usando el gráfico estime los valores de la entalpía molar parcial para el n-octanol a dilución infinita y para el n-decano a dilución infinita.
Punto 2
A presión atmosférica, la mezcla acetona (1) / cloroformo (2) forma un azeótropo a 64,6°C, el cual tiene una concentración molar de acetona en la fase líquida del 33,5%. A 64,6°C la presión de saturación de la acetona es 1,31 atmósferas y la del cloroformo 0,98 atmósferas. El comportamiento de la solución liquida puede ser descrito por la ecuación de Van Laar:
![<tex>\mathit{ln \gamma _1= A _{12} \left.[1+(A _{12} \cdot x _{1} \right/ A _{21} \cdot x _2 )] ^{-2}} \qquad \mathit{ln \gamma _2= A _{21} \left.[1+(A _{21} \cdot x _{2} \right/ A _{12} \cdot x _1 )] ^{-2}}</tex> <tex>\mathit{ln \gamma _1= A _{12} \left.[1+(A _{12} \cdot x _{1} \right/ A _{21} \cdot x _2 )] ^{-2}} \qquad \mathit{ln \gamma _2= A _{21} \left.[1+(A _{21} \cdot x _{2} \right/ A _{12} \cdot x _1 )] ^{-2}}</tex>](lib/plugins/latex/images/84f2090dea933b219e4cfaecf22be435d90ab6b7_0.png)
- a) Plantee la forma general de la ecuación que gobierna el equilibrio liquido vapor. Liste la suposiciones que considere adecuadas para este problema. Justifique debidamente cada una de ellas, y halle la ecuación modificada para las condiciones del problema.
- b) Calcule los coeficientes de actividad de la acetona y del cloroformo en el azeótropo.
- c) Determine el valor de la energía libre de Gibbs en exceso, en kcal/kmol, para el azeótropo.
- d) Calcule la presión que se ejerce a 64,6°C sobre una solución liquida de acetona (1) / cloroformo (2) que contiene 12 % molar de acetona. Considere:
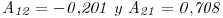
- e) Calcule la composición del vapor en equilibrio con la solución liquida en las condiciones de (d).
Excepto donde se indique lo contrario, el contenido de esta wiki se autoriza bajo la siguiente licencia: CC Attribution-Noncommercial-Share Alike 3.0 Unported
