Tabla de Contenidos
Parcialito Disolución y Disgregación - 18/03/2009
Cátedra: Miércoles 13hs, Ana María Martín
Esta página está incompleta; podés ayudar completando el material.
Enunciado
- Expliqure por qué es necesario poner en analito en solución
- Describa la disgregación de
 y escriba las reacciones químicas correspondientes
y escriba las reacciones químicas correspondientes
Resolución
Punto 1
INCOMPLETO
Punto 2
Para disgregar el  se utiliza el
se utiliza el  - Se ponen en contacto íntimo en proporción10:1 y se calienta hasta fusión. A altas temperaturas el
- Se ponen en contacto íntimo en proporción10:1 y se calienta hasta fusión. A altas temperaturas el  reaciona formando
reaciona formando 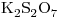 :
:
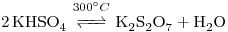
El tubo se sumerge en ácido sulfúrico al 5% que disuelve el sólido por la reacción:

Entonces el  queda disuelto en el
queda disuelto en el  al 5%. Su presencia se detecta agregando gotas de
al 5%. Su presencia se detecta agregando gotas de  que da coloración amarilla:
que da coloración amarilla:
![<tex>\ce{Ti^{VI} + H2O2 <=> 2 H+ + } \underbrace{\ce{ [TiO2]^{2+} }}_{\mbox{peroxocomplejo}\atop \mbox{soluble amarillo}}</tex> <tex>\ce{Ti^{VI} + H2O2 <=> 2 H+ + } \underbrace{\ce{ [TiO2]^{2+} }}_{\mbox{peroxocomplejo}\atop \mbox{soluble amarillo}}</tex>](lib/plugins/latex/images/0751e7fecec51ba941f2c7b6fe930bf286eec20e_0.png)
Excepto donde se indique lo contrario, el contenido de esta wiki se autoriza bajo la siguiente licencia: CC Attribution-Noncommercial-Share Alike 3.0 Unported
