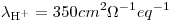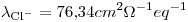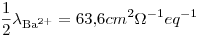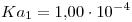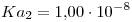Segundo Recuperatorio - 63.15. Química Analítica Instrumental - 17/12/2007
Cátedra: Única
Fecha: 3° Oportunidad - (2º Cuatrimestre 2007)
Día: 17/12/2007
Enunciado
Resuelva cada ejercicio en hojas diferentes. No se permite escribir en lápiz. Para aprobar este examen debe responder bien como mínimo el 50% de cada problema.
Punto 1
¿Cuál es la conductancia de una solución de BaCl2 0,0200M a 25º C medida en una celda cuya constante es 1,129 cm-1?
Datos:
Punto 2
El fluoruro de una muestra de 0,7850g se precipitó como 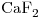 , mediante el agregado de 50,00mL de una solución 0,0205M de
, mediante el agregado de 50,00mL de una solución 0,0205M de  . La titulación del exceso de ion calcio en el filtrado y los líquidos de lavado requirió 8,20mL de una solución de EDTA. La titilación directa de una porción de 25,00mL de la solución de calcio requirió 41,40mL de la solución de EDTA. Calcular el porcentaje de fluoruro en la muestra.
. La titulación del exceso de ion calcio en el filtrado y los líquidos de lavado requirió 8,20mL de una solución de EDTA. La titilación directa de una porción de 25,00mL de la solución de calcio requirió 41,40mL de la solución de EDTA. Calcular el porcentaje de fluoruro en la muestra.
Datos:
- Ar F = 18,9984
Punto 3
Una solución acuosa puede contener  ,
, 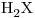 ,
,  ,
, 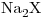 ó una mezcla binaria compatible. 50,00mL de la muestra requieren 14,00mL de solución 0,250M de NaOH para llegar al primer punto de equivalencia a pH = 6,0 y 33,00mL más para llegar al segundo punto de equivalencia a pH = 10,5.
ó una mezcla binaria compatible. 50,00mL de la muestra requieren 14,00mL de solución 0,250M de NaOH para llegar al primer punto de equivalencia a pH = 6,0 y 33,00mL más para llegar al segundo punto de equivalencia a pH = 10,5.
- a) Indique cuál es la composición de la muestra y por qué descarta las otras opciones.
- b) Calcule la molaridad del o los componentes de la solución.
- c) Con qué sistema de electrodos podría llevar a cabo esta titilación potenciométricamente.
Datos:
Punto 4
Una mezcla, que contiene solamente  ,
,  y
y 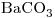 , tiene 28,5% de Calcio y 32,0%
, tiene 28,5% de Calcio y 32,0%  . Calcule los porcentajes
. Calcule los porcentajes  ,
,  y
y 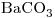 en la muestra.
en la muestra.
Datos:
- Ar
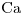 = 40,08
= 40,08 - Mr
 = 44,01
= 44,01 - Mr
 = 100,09
= 100,09 - Mr
 = 136,14
= 136,14 - Mr
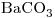 = 197,35
= 197,35
Punto 5
- a) Explique las condiciones generales de una gravimetría por precipitación.
- b) ¿Qué método es más selectivo, el potenciométrico o el conductimétrico? ¿Por qué?
- c) ¿En que casos es necesario emplear el método de agregado patrón? Dé un ejemplo.
- d) ¿Cuál es la utilidad del método del estándar interno?