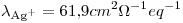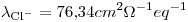Primer Recuperatorio - 63.15. Química Analítica Instrumental - 12/11/2007
Cátedra: Única
Fecha: 2° Oportunidad - (2º Cuatrimestre 2007)
Día: 12/11/2007
Enunciado
Resuelva cada ejercicio en hojas diferentes. No se permite escribir en lápiz. Para aprobar este examen debe responder bien como mínimo el 50% de cada problema.
Punto 1
Un precipitado, mezcla de  y
y  se analiza mediante gravimetría por precipitación. Después de calentarlo para formar
se analiza mediante gravimetría por precipitación. Después de calentarlo para formar  y
y 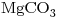 el precipitado pesa 0,4123g. Por ignición hasta CaO y MgO el peso es de 0,2943g. Calcule el contenido de Ca en la muestra, expresado como CaO.
el precipitado pesa 0,4123g. Por ignición hasta CaO y MgO el peso es de 0,2943g. Calcule el contenido de Ca en la muestra, expresado como CaO.
Datos:
- Mr
 = 100,09
= 100,09 - Mr
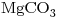 = 84,31
= 84,31 - Mr CaO = 56.08
- Mr MgO = 40,30
- Mr
 =128,08
=128,08 - Mr
 =112,30
=112,30 - Ar Ca = 40,08
Punto 2
El producto de solubilidad del AgCl a 25º C vale 1,8.10-10. Calcule la conductancia de una solución saturada de AgCl, medida en una celda cuya constante vale 0.50cm-1, considerando desestimable la corrección por disolvente.
Datos:
Punto 3
Se ha medido la concentración de ion fluoruro en agua de un rió, a 25º C, por medio de un electrodo selectivo de fluoruros. El sistema de electrodos sumergido en 10,00mL de una muestra presentó un potencial de 358,7mV medido frente a un electrodo de calomel saturado. Después de agregar 1.00mL de una solución patrón de una concentración 0,050M en fluoruro el potencial disminuyó a 346,1mV. Calcule el contenido de fluoruro del agua en ppm de NaF.
Datos:
- Mr NaF = 42,987
- E(ECS) = 0,241V
Punto 4
Dé un ejemplo y describa los distintos tipos de electrodos indicadores.
Punto 5
Una solución contiene HCl y  . La titilación de alícuotas de 20,00mL de esta solución requiere 25,40mL de solución 0,1080N de NaOH cuando se usa verde de bromocresol y 37,00mL de la misma base cuando se emplea timolftaleína como indicador. Calcule la concentración de HCl en la solución.
. La titilación de alícuotas de 20,00mL de esta solución requiere 25,40mL de solución 0,1080N de NaOH cuando se usa verde de bromocresol y 37,00mL de la misma base cuando se emplea timolftaleína como indicador. Calcule la concentración de HCl en la solución.
Datos:
- Ka1
 = 5,9.10-3
= 5,9.10-3 - Ka2 = 6,17.10-8
- Ka3 = 4,8.10-13
| Indicador | Rango de pH de viraje | Colores |
|---|---|---|
| Verde de Bromocresol | 3,8 – 5,4 | Amarillo – azul |
| Timolftaleína | 9,5 – 10,5 | Incoloro - azul |