Primer Parcial - 63.15. Química Analítica Instrumental - 29/10/2007
Cátedra: Única
Fecha: 1° Oportunidad - (2º Cuatrimestre 2007)
Día: 29/10/2007
Enunciado
Resuelva cada ejercicio en hojas diferentes. No se permite escribir en lápiz. Para aprobar este examen debe responder bien como mínimo el 50% de cada problema.
Punto 1
Una mezcla de CaO y BaO pesa 0,6411g y luego de precipitarlos, filtrarlos y secarlos, da 1,1200g de una mezcla de sulfatos anhídridos. Determine el porcentaje de Ba y de Ca en la mezcla original.
Datos:
- Ar
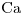 = 40,08
= 40,08 - Ar
 = 137,33
= 137,33 - Mr
 = 56.08
= 56.08 - Mr
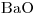 = 153,33
= 153,33 - Mr
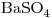 = 233,38
= 233,38 - Mr
 = 136,14
= 136,14
Punto 2
Una solución acuosa contiene solamente  (en concentración molar
(en concentración molar  ) y
) y 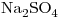 (en concentración molar
(en concentración molar 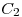 ). Se colocan 150,0mL en una celda conductimétrica (constante
). Se colocan 150,0mL en una celda conductimétrica (constante 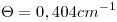 ) y se lee una resistencia de
) y se lee una resistencia de 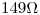 .
Otra alícuota de 20,00mL se titula en medio ácido con
.
Otra alícuota de 20,00mL se titula en medio ácido con 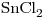 0,0500M, consumiéndose 20,00mL.
El reactivo titulante reacciona según:
0,0500M, consumiéndose 20,00mL.
El reactivo titulante reacciona según:

Calcular la concentración molar de ambas sales en la muestra.
Datos: Conductancias iónicas equivalentes (cm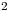 .Ω
.Ω eq
eq )
)
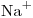 = 50,0
= 50,0  = 349,0
= 349,0  = 41,0
= 41,0 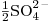 = 80,0
= 80,0 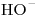 = 192
= 192
Punto 3
Una solución acuosa contiene  (pKa1 = 2),
(pKa1 = 2),  (pKa2 = 7),
(pKa2 = 7),  (pKa3 = 12), aislados o mezclados en diversas combinaciones compatibles. Se efectúan valoraciones con NaOH 0,100N hasta que la fenolftaleína vira a rosado, luego la misma se valora por retorno con HCl 0,100N hasta color rojo de la heliantina. Justifique cual es la composición cualitativa de la muestra si los volúmenes empleados son:
(pKa3 = 12), aislados o mezclados en diversas combinaciones compatibles. Se efectúan valoraciones con NaOH 0,100N hasta que la fenolftaleína vira a rosado, luego la misma se valora por retorno con HCl 0,100N hasta color rojo de la heliantina. Justifique cual es la composición cualitativa de la muestra si los volúmenes empleados son:
- a) Valoración inicial: 48,30mL; retorno 33,72mL.
- b) Valoración inicial: 36,24mL; retorno 18,12mL.
- c) Valoración inicial: 24,36mL; retorno 24,36mL.
Punto 4
Se desea resolver cuantitativamente las siguientes muestras, por titulación potenciométrica:
- a)
 en agua.
en agua. - b)
 en
en  1M.
1M.
Indique y justifique en cada caso: titulante elegido, reacción de titulación, electrodos a usar, forma de la curva de titulación registrada, método gráfico de obtención del punto final.
Punto 5
Responda verdadero o falso, justificando su respuesta:
- a) El electrodo de membrana de
 (s) puede usarse para determinar el contenido de NaF igualmente bien a cualquier pH.
(s) puede usarse para determinar el contenido de NaF igualmente bien a cualquier pH. - b) El error introducido por el uso de material volumétrico mal calibrado puede reducirse aumentando el numero de determinaciones a promediar.
- c) Cuando se determina
 en suero sanguíneo (admita que la respuesta del instrumento es lineal con la concentración del analito) debe emplearse el método de adiciones estándar (o agregado patrón).
en suero sanguíneo (admita que la respuesta del instrumento es lineal con la concentración del analito) debe emplearse el método de adiciones estándar (o agregado patrón). - d) Una solución que contiene un mol de
 , que actúa como reductor, contiene 2 equivalentes de dicha especie.
, que actúa como reductor, contiene 2 equivalentes de dicha especie.
