Ejercicios complementarios - Guía 1 - 63.11 Química Aplicada A
Conceptos a desarrollar
Descripción Termodinámica de la Materia
Leyes generales de conservación: masa y energía. Formulación general del balance para una propiedad conservada. Balance de energía total para un sistema abierto. Entalpía. Sistema cerrado: primera ley de la termodinámica. Leyes termoquímicas. Balance para una propiedad no conservada. Entropía (S). Proceso reversible. Expresiones de balance de masa, energía y entropía para sistemas abiertos y cerrados a P y T constantes. Potenciales termodinámicos: Energía libre de Gibbs (G). Criterios de equilibrio: condiciones para S y G; segunda ley de la termodinámica. Equilibrio mecánico, térmico y químico. Cambio en las funciones de estado de un gas ideal.
Ej 1 (resuelto)
Conteste verdadero o falso o no se puede predecir. Si el enunciado es falso, rescribalo de forma que sea verdadero. Si no se puede predecir, explique por que. Indique la convencion de signos usada.
En una expansion isobarica cuasiestatica, seguida de una expansion adiabatica
cuasiestatica de un gas ideal, se cumple que:
a) W>0
b) En el proceso isobarico la temperatura final es mayor que la inicial
c) En el proceso adiabatico, la temperatura final es mayor que la inicial
d) 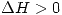
e) 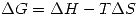
f) 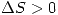
g) 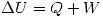
h) 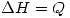
i) 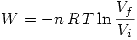
j) 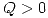
Solución
Ej 2 (resuelto)
Un mol de un liquido a 10º C se sumerge en un bano de gran capacidad de agua y hielo, a 0º C. Indique el estado final del sistema. Calcule  del liquido, del agua y del universo. Indique si el proceso es espontaneo.
del liquido, del agua y del universo. Indique si el proceso es espontaneo.
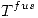 del liquido = 5.5 ºC;
del liquido = 5.5 ºC; 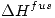 del liquido = 10.59 kJ/mol
del liquido = 10.59 kJ/mol
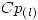 = 3,2 kJ/moI K
= 3,2 kJ/moI K 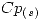 = 2.5 kJ/mol K
= 2.5 kJ/mol K
Solución
Ej 3 (resuelto)
Un mol de gas ideal monoatomico se somete a los siguientes procesos reversibles:
a) estando inicialmente a 25 ºC y 1 atm se expande isotermicamente hasta duplicar su
volumen.
b) el gas se calienta a 125 ºC isocoricamente.
c) el gas se expande a temperatura constante hasta duplicar su volumen nuevamente
d) el gas se enfria hasta 25º C y presion constante.
Calcular: 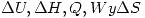 para cada etapa.
para cada etapa.
Solución
Ej 4 (resuelto)
Un sistema contiene 7,14 g de Ne a 0 ºC y 1 atm. Cuando se adicionan al sistema
2025 J de calor a presion constante, la expansion resultante hace que el sistema
entregue 810 J de trabajo. Calcular:
a) estado inicial
b) estado final
c)  ,
,  para el proceso
para el proceso
d) Cp, Cv (comprobar que Cp = 5/2 R. y Cv = 3/2 R)
El neon se comporta como gas ideal. 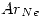 = 20
= 20
Solución
Ej 5 (resuelto)
El ciclo de la figura lo realiza un mol de gas ideal cuyo Cv = 3 cal / mol K. Si el area bajo la curva 3-1 corresponde a 400 cal , y 1-2 es una etapa irreversible, calcular  en cada proceso.
en cada proceso.  = 200 K ;
= 200 K ;  = 300 K.
= 300 K.

Solución
Ej 6 (resuelto)
La capacidad molar del 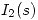 a 1 atm de presion esta descripta por:
a 1 atm de presion esta descripta por:
Cp = 12,97 + 3,21 x 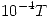 (cal/mol K)
(cal/mol K)
Si la capacidad calorifica molar del 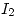 liquido es aproximadamente constante e igual a 19,5 cal /mol K; el calor normal de vaporizacion del yodo es de 6100 cal /mol y el calor normal de fusion es 3740 cal /mol.
liquido es aproximadamente constante e igual a 19,5 cal /mol K; el calor normal de vaporizacion del yodo es de 6100 cal /mol y el calor normal de fusion es 3740 cal /mol.
Calcular el calor necesario y la variacion de entropia que acompaña a la vaporizacion de un mol de yodo desde 25 ºC hasta 184 ºC.
Temperatura normal de ebullicion del yodo = 184 ºC
Temperatura normal de fusion del yodo = 113.6 ºC
Solución
Ej 7
A la presion de 1 atm, la temperatura de fusion del plomo es 600 K. Si dos moles de plomo inicialmente a 590 K y 1 atm, se llevan a 610 K. Calcular la variacion de entropia asociada.
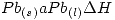 (600K, 1atm) = 4810 J
Cp_{Pb(l)} = 32,4 . 3,1 x 10-3 T ( J / mol K )
(600K, 1atm) = 4810 J
Cp_{Pb(l)} = 32,4 . 3,1 x 10-3 T ( J / mol K )
Cp_{Pb(s)} = 23,6 + 9,75 x 10-3 T (J / mol K)
Solución
Ej 8
100 ml de agua, inicialmente a 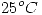 y 1 atm, se comprimen isotermicamente hasta 100 atm. Suponiendo que el agua es incompresible. Calcular la variacion de energia libre de Gibbs.
y 1 atm, se comprimen isotermicamente hasta 100 atm. Suponiendo que el agua es incompresible. Calcular la variacion de energia libre de Gibbs.
Solución
Ej 9
Calcular el cambio de energia libre de Gibbs durante la expansion de 2 moles de gas ideal desde 1 atm a 0,1 atm, a 298 K.
Solución
Ej 10
Una hoja de oro que pesa 10,0 g se encuentra a una temperatura de 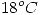 y se coloca sobre una delgada hoja de hierro que pesa 20,0 g y que esta a una temperatura de
y se coloca sobre una delgada hoja de hierro que pesa 20,0 g y que esta a una temperatura de 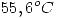 en un recipiente adiabatico. Calcule
en un recipiente adiabatico. Calcule  del oro, del hierro, del sistema global, del medio y del universo.
del oro, del hierro, del sistema global, del medio y del universo.
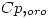 = 0,129 J/g K
= 0,129 J/g K
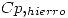 = 0,385 J/g K
= 0,385 J/g K
Solución

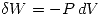 (es decir el trabajo realizado hacia el sistema o Convención egoista) entonces como es una expansión
(es decir el trabajo realizado hacia el sistema o Convención egoista) entonces como es una expansión 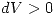 y por lo tanto
y por lo tanto 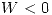 .
.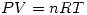 Como en este caso
Como en este caso 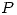 y
y 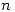 son constantes y
son constantes y 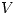 aumenta por lo tanto
aumenta por lo tanto 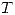 aumenta, esto es pues aplicando la ecuación de estado a los estados final e inicial, y dividiendo ambas ecuaciones se obtiene
aumenta, esto es pues aplicando la ecuación de estado a los estados final e inicial, y dividiendo ambas ecuaciones se obtiene 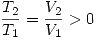 . Por lo tanto es verdadera.
. Por lo tanto es verdadera. y como es un gas ideal se reemplaza
y como es un gas ideal se reemplaza 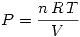 y se obtiene
y se obtiene 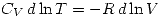 por lo tanto como
por lo tanto como 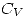 (gas ideal) y
(gas ideal) y 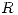 son constantes, cuando aumenta el volumen, disminuye la temperatura. Falsa.
son constantes, cuando aumenta el volumen, disminuye la temperatura. Falsa.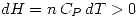 y por lo tanto
y por lo tanto 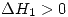 . Para la segunda evolución se sabe que es adiabática que el gas es ideal y por lo tanto
. Para la segunda evolución se sabe que es adiabática que el gas es ideal y por lo tanto 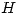 sigue siendo sólo función de la temperatura y por lo tanto como la temperatura disminuye
sigue siendo sólo función de la temperatura y por lo tanto como la temperatura disminuye 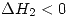 . Entonces como no se tiene ninguna magnitud no se puede determinar.
. Entonces como no se tiene ninguna magnitud no se puede determinar.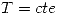 .
.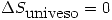 . En la primera además se libera calor al medio y por lo tanto se intercambiará entropía con el medio; y como el calor es ganado entonces el sistema gana entropía y
. En la primera además se libera calor al medio y por lo tanto se intercambiará entropía con el medio; y como el calor es ganado entonces el sistema gana entropía y 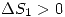 . Además en la segunda ecuación el sistema está aislado y por lo tanto
. Además en la segunda ecuación el sistema está aislado y por lo tanto 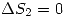 . Entonces
. Entonces 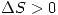 .
.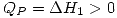 el total
el total 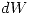 por
por 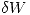 porque es un diferencial inexacto. W no es una funcion de estado, es decir, depende de la trayectoria que tome la evolucion. También agregue algunos espacios en las ecuaciones con esto:
porque es un diferencial inexacto. W no es una funcion de estado, es decir, depende de la trayectoria que tome la evolucion. También agregue algunos espacios en las ecuaciones con esto:
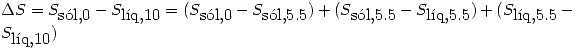
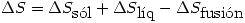
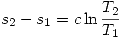
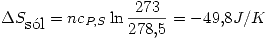
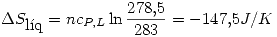
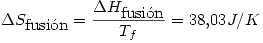
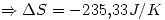
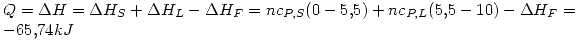
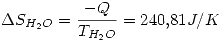
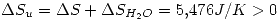 lo que indica que es espontáneo (como es de esperar).
lo que indica que es espontáneo (como es de esperar).
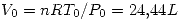
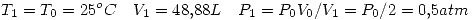
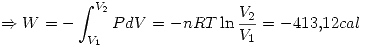
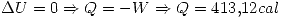
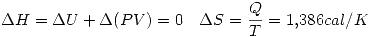
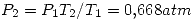
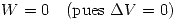
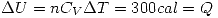
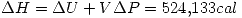
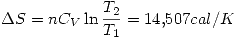
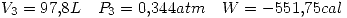
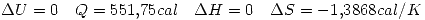
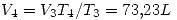
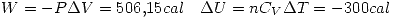
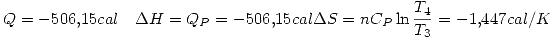
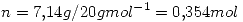
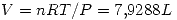
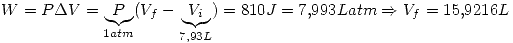
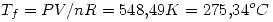
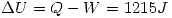
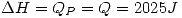
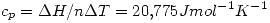
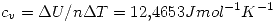
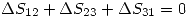
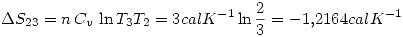
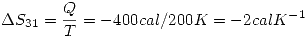
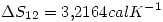 por la primer ecuación.
por la primer ecuación.
![<tex> \begin{array}{rcl}Q & = & Q_{25\rightarrow 113.6}+Q_{\mbox{fusi\'on}}+Q_{113.6\rightarrow 184}+Q_{\mbox{vaporizaci\'on}}\\ & = & \displaystyle n\int_{298K}^{386.6K} \!\!\!\! C_p^S dT + n\lambda_f + nC_p^L(184^oC-113.6^oC)+n\lambda_b \\ & = & \displaystyle \left[ 12.97(113.6-25)+\frac{3.21\cdot 10^{-1}}{2}(386.6^2-298^2)+3740+19.5(184-113.6)+6100 \right] cal\\ & = & 12371.7 cal \end{array}</tex> <tex> \begin{array}{rcl}Q & = & Q_{25\rightarrow 113.6}+Q_{\mbox{fusi\'on}}+Q_{113.6\rightarrow 184}+Q_{\mbox{vaporizaci\'on}}\\ & = & \displaystyle n\int_{298K}^{386.6K} \!\!\!\! C_p^S dT + n\lambda_f + nC_p^L(184^oC-113.6^oC)+n\lambda_b \\ & = & \displaystyle \left[ 12.97(113.6-25)+\frac{3.21\cdot 10^{-1}}{2}(386.6^2-298^2)+3740+19.5(184-113.6)+6100 \right] cal\\ & = & 12371.7 cal \end{array}</tex>](lib/plugins/latex/images/9afd8994d0c5cc8e4df89d056db268cc80e5a571_0.png)
![<tex> \begin{array}{rcl}\Delta S & = & \displaystyle n\int_{298K}^{386.6K} \frac{C_p^S}{T} dT + n\frac{\lambda_f}{T_f} + nC_p^L\ln{\frac{457}{386.6}}+n\frac{\lambda_b}{T_b} \\ & = & \displaystyle \left[ 12.97\ln\frac{386.6}{298}+3.21\cdot 10^{-4}(113.6-25)+\frac{3740}{386.6}+19.5\ln\frac{457}{386.6}+\frac{6100}{457} \right] cal/K\\ & = & 29.688cal/K \end{array}</tex> <tex> \begin{array}{rcl}\Delta S & = & \displaystyle n\int_{298K}^{386.6K} \frac{C_p^S}{T} dT + n\frac{\lambda_f}{T_f} + nC_p^L\ln{\frac{457}{386.6}}+n\frac{\lambda_b}{T_b} \\ & = & \displaystyle \left[ 12.97\ln\frac{386.6}{298}+3.21\cdot 10^{-4}(113.6-25)+\frac{3740}{386.6}+19.5\ln\frac{457}{386.6}+\frac{6100}{457} \right] cal/K\\ & = & 29.688cal/K \end{array}</tex>](lib/plugins/latex/images/d1ffaf27f6422cd7f87410df30ce33ab02c8aa32_0.png)