Tabla de Contenidos
Examen Parcial - 63.07. Química Física II
Cátedra: Unica
Fecha: Tercera Oportunidad - Primer Cuatrimestre 2002
Día: 11/07/2002
Enunciado
Punto I
(30 puntos) El producto de solubilidad del  en agua a
en agua a 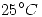 es
es 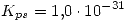 .
.
- Estimar, usando la ley límite de Debye-Hückel, la solubilidad
 del
del  en agua y en una solución
en agua y en una solución 
- Calcular el potencial estándar y la fem de la celda:

- Calcular la energía libre estándar de formación del ion
 acuoso.
acuoso.
Datos:

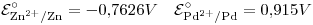
Punto II
(20 puntos) La conductividad de una solución saturada de 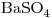 es
es 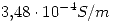 . La conductividad del agua pura es
. La conductividad del agua pura es 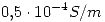 . Calcúlese el producto de solubilidad de
. Calcúlese el producto de solubilidad de 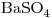 .
.
Datos: Conductividad equivalente de 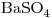 :
: 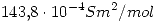
Punto III
(35 puntos) Para la pirólisis del 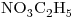 se propone el siguiente mecanismo:
se propone el siguiente mecanismo:
![<tex> \begin{array}{lll}\ce{NO3C2H5} & \ce{->[k_1]} & \ce{C2H5O}^* + \ce{NO2}\\\ce{C2H5O}^* & \ce{->[k_2]} & \ce{CH3}^* + \ce{CH2O}\\\ce{CH3}^*+\ce{NO3C2H5} & \ce{->[k_3]} & \ce{C2H5O}^*+\ce{CH3NO2}\\\ce{2C2H5O}^* & \ce{->[k_4]} & \ce{C2H5OH}+\ce{CH3CHO}\end{array} </tex> <tex> \begin{array}{lll}\ce{NO3C2H5} & \ce{->[k_1]} & \ce{C2H5O}^* + \ce{NO2}\\\ce{C2H5O}^* & \ce{->[k_2]} & \ce{CH3}^* + \ce{CH2O}\\\ce{CH3}^*+\ce{NO3C2H5} & \ce{->[k_3]} & \ce{C2H5O}^*+\ce{CH3NO2}\\\ce{2C2H5O}^* & \ce{->[k_4]} & \ce{C2H5OH}+\ce{CH3CHO}\end{array} </tex>](lib/plugins/latex/images/2b773d30a2b1451a96c2108e557cc391dd4c996f_0.png)
- Encontrar la expresión de velocidad para la formación de
 que resulta del mecanismo indicado, utilizando la aproximación de estado estacionario.
que resulta del mecanismo indicado, utilizando la aproximación de estado estacionario. - Si la ley de velocidad de formación de
 observada sigue una ley del tipo
observada sigue una ley del tipo ![<tex> r=k[\ce{NO3C2H5}]^\alpha </tex> <tex> r=k[\ce{NO3C2H5}]^\alpha </tex>](lib/plugins/latex/images/9d09f4be1a964ad822436562e5146394f1fb698a_0.png) encuentre la constante de velocidad y el orden que surge de los siguientes datos experimentales:
encuentre la constante de velocidad y el orden que surge de los siguientes datos experimentales:
![<tex> \begin{array}{|c|c|} \hliner_{\ce{C2H5OH}}(mol/m^3h) & [\ce{NO3C2H5}]\mbox{inicial}(mol/m^3)\\\hline 12.1 & 0.0876 \\ \hline 12.2 & 0.0890 \\\hline 13.4 & 0.1074 \\ \hline 20.0 & 0.2392 \\\hline 23.0 & 0.3164 \\ \hline \end{array} </tex> <tex> \begin{array}{|c|c|} \hliner_{\ce{C2H5OH}}(mol/m^3h) & [\ce{NO3C2H5}]\mbox{inicial}(mol/m^3)\\\hline 12.1 & 0.0876 \\ \hline 12.2 & 0.0890 \\\hline 13.4 & 0.1074 \\ \hline 20.0 & 0.2392 \\\hline 23.0 & 0.3164 \\ \hline \end{array} </tex>](lib/plugins/latex/images/04e8c4828eb94755cffefbe9c655f41ad26c28ac_0.png)
¿Es el mecanismo del punto 1 consistente con la ley de velocidad hallada?. Justifique.
Punto IV
(15 puntos) Decida si las siguientes afirmaciones son verdaderas o falsas. Justifique su elección.
- La conductividad térmica de un gas ideal disminuye con la presión siempre que el camino libre medio de las moléculas sea mucho menor que el tamaño del recipiente que contiene al gas.
- La difusión del nitrógeno a
 y
y  es mayor que la del hidrógeno a
es mayor que la del hidrógeno a  y
y  .
.
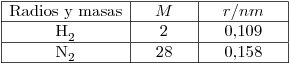
Resolución
Discusión
Si ves algo que te parece incorrecto en la resolución y no te animás a cambiarlo, dejá tu comentario acá.
Sugerencia de estilo: Usar headers en las tablas, i.e.:
| Header |
|---|
| Tabla |
— Sebastián Santisi 2006/11/08 15:33
Al convertir de tex a ce reemplacé las expresiones de la onda de:
 por cosas del estilo de:
por cosas del estilo de:
![<tex>\ce{NO3C2H5} \ce{->[k_1]} \ce{C2H5O}^* + \ce{NO2}</tex> <tex>\ce{NO3C2H5} \ce{->[k_1]} \ce{C2H5O}^* + \ce{NO2}</tex>](lib/plugins/latex/images/2c1fc7e45af5bb61695fcb221add9af27887a33f_0.png) Deshacer el cambio si estuviera mal el stack en la flecha.
Deshacer el cambio si estuviera mal el stack en la flecha.
 por cosas del estilo de:
por cosas del estilo de:
![<tex>\ce{NO3C2H5} \ce{->[k_1]} \ce{C2H5O}^* + \ce{NO2}</tex> <tex>\ce{NO3C2H5} \ce{->[k_1]} \ce{C2H5O}^* + \ce{NO2}</tex>](lib/plugins/latex/images/2c1fc7e45af5bb61695fcb221add9af27887a33f_0.png) Deshacer el cambio si estuviera mal el stack en la flecha.
Deshacer el cambio si estuviera mal el stack en la flecha.
— Sebastián Santisi 2007/06/25 01:49
Excepto donde se indique lo contrario, el contenido de esta wiki se autoriza bajo la siguiente licencia: CC Attribution-Noncommercial-Share Alike 3.0 Unported
