Examen Final - 63.06. Química Física I
Cátedra: Teresa Pérez
Fecha: 2ª Oportunidad - Segundo Cuatrimestre 2002
Día: 18/12/2002
Enunciado
En un reactor se desea obtener el producto E mediante la reacción:
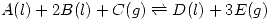
El reactor opera a  y
y  (
(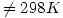 ) y es alimentado por una corriente que contiene
) y es alimentado por una corriente que contiene 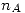 ,
, 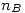 y
y 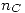 moles de los reactivos.
moles de los reactivos.
- Detalle como calcularía la cantidad máxima de E que es posible obtener en esas condiciones de operación.
- ¿Qué variables modificaría para aumentar la cantidad de E obtenida? Justifique.
Datos:
- C y E forman una solución ideal de gases reales y se conocen las temperaturas y presiones criticas de cada uno de los gases puros.
- A y D forman una solución de comportamiento regular. Se determino que al formar una solución equimolar de A y D a temperatura y presión constante, a partir de los líquidos puros, el calor intercambiado entre sistema y medio fue de –400cal.
- El liquido B es inmiscible con la solución que forman A y D.
- Los gases presentan una muy baja solubilidad y puede despreciarse el contenido de A, B y D en la fase gaseosa.
- Se sabe que el
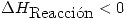
- Cuenta con las tablas con datos termodinámicos de los compuestos puros.
Tiempo de resolución: 1 hora.
Observación: Debe hacerse una presentación detallada de cada paso de cálculo, indicando los datos necesarios en cada caso y como obtenerlos.
Resolución
La idea es nombrar los pasos que deberían hacerse para hallar la cantidad de sustancia E que habrá en el equilibrio.
| A(l) | 2 B(l) | C(g) | D(l) | 3 E(g) | |
|---|---|---|---|---|---|
| Inicial | 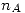 | 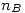 | 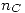 | - | - |
| Equilibrio | 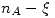 | 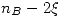 | 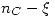 |  | 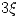 |
De aquí despejaremos las concentraciones en el equilibrio (B es inmiscible en A y D, por lo que no afecta a la concentración):
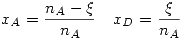
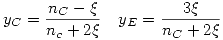
La expresión para la constante de equilibrio en este caso está dada por: 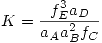
Del dato 1, vemos que: 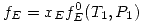 y
y 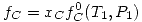 .
.
Del dato 3 observamos que 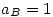 .
.
El dato dos se interpreta sabiendo que el calor de disolución para una solución regular es 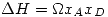 . Utilizando los datos de allí, despejamos
. Utilizando los datos de allí, despejamos 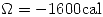 .
.

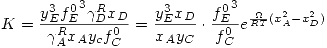
Determinación de K
Con los datos termodinámicos de 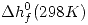 y
y 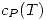 se hallan:
se hallan: 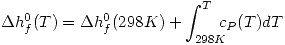 . Si ocurriese un cambio de estado en realidad debería aplicar la fórmula
. Si ocurriese un cambio de estado en realidad debería aplicar la fórmula 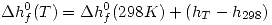 (Suponiendo P suficientemente baja).
(Suponiendo P suficientemente baja).
Luego se halla 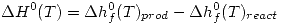
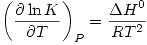
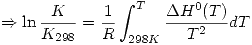
Determinación de las fugacidades para E y C
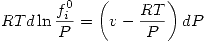
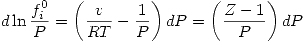
Entonces: 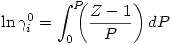
Esta integral debe resolverse gráficamente usando los valores reducidos de E y C. De aquí se podría despejar 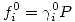
Ahora entonces ya se pudo calcular K y los datos de las fugacidades. Por lo tanto reemplazando los datos en la fórmula antes hallada queda:
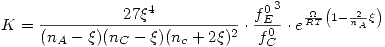
En esta ecuación ya son todos datos, excepto  . Entonces debería despejarlo (o aproximarlo mediante iteraciones).
. Entonces debería despejarlo (o aproximarlo mediante iteraciones).
Una vez que haga eso la cantidad de E en el equilibrio es 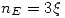
La parte 2 que pregunta que variables modificaría para mejorar el rendimiento. Una podría ser disminuír la temperatura, pues como el dato 5 dice que 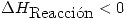 y
y
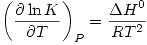 , entonces
, entonces
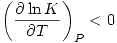 . Por lo tanto una disminución de la temperatura aumentaría el valor de K, y por lo tanto aumentaría el rendimiento.
. Por lo tanto una disminución de la temperatura aumentaría el valor de K, y por lo tanto aumentaría el rendimiento.
