Exámen Parcial - 63.02. Química I
Cátedra: Sánchez
Fecha: 2ª Oportunidad - 1º Cuatrimestre 2009
Día: 29/06/2009
Enunciado
Ejercício 1
Ordenar según pH creciente las siguientes soluciones acuosas, considerando cuando sea necesario volúmenes aditivos:
a) 10 mL de solución de ácido clorhídrico 20% m/m y densidad 1,1 g/mL diluídos a 500 mL con agua.
b) 10 mL de solución de ácido clorhídrico 20% m/m y densidad 1,1 g/mL a los que se agregan 200 mL de disolución de hidróxido de calcio 0,3 M.
c) 100 mL de solución de HA 0,1 M (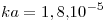 ) a los que se le agregan 1000 mL de hidróxido de potasio 0,1 M.
) a los que se le agregan 1000 mL de hidróxido de potasio 0,1 M.
Ejercício 2
a) 2,21 g de un metal M desplazan 4,06 g de cobre de una solución de sulfato cúprico. Calcular el número de oxidación del metal.
b) Dados los electrodos: 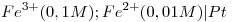 y
y 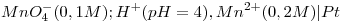
i) Armar una celda galvánica. Fundamentar mediante cálculo.
ii) Calcular la constante de equilibrio.
Ejercício 3
A 200°C y 1 atm el 48,5% (en moles) de 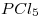 se disocia dando
se disocia dando 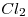 y
y 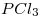 . Calcular el % de disociación a 200°C y a una presión de 10 atm. Justificar el resultado obtenido sabiendo que en esas condiciones todos los compuestos son gases.
. Calcular el % de disociación a 200°C y a una presión de 10 atm. Justificar el resultado obtenido sabiendo que en esas condiciones todos los compuestos son gases.
Ejercício 4
Indicar si las siguientes afirmaciones son verdaderas o falsas. Fundamentar la respuesta:
a) Cuanto más pequeña es la disociación de un ácido mayor es la hidrólisis de sus sales.
b) El pH de una solución de hidróxido de sodio 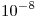 M es 6. Justificar mediante cálculo.
M es 6. Justificar mediante cálculo.
c) El Kps del carbonato de calcio es mayor que el Kps del hidróxido de magnesio entonces se puede afirmar que la solubilidad molar del carbonato de calcio es mayor que la solubilidad molar del hidróxido de magnesio.
d) Para la reacción endotérmica A(g) + B(g) ↔ C(g) cuando aumenta la temperatura aumenta el rendimiento de la reacción.
