Exámen Parcial - 63.02. Química I
Cátedra: Sánchez
Fecha: 2ª Oportunidad - 1º Cuatrimestre 2009
Día: 23/06/2009
Enunciado
Ejercício 1
Dada la siguiente ecuación química
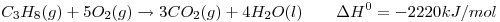
Suponiendo una eficiencia del 70%, calcular la masa de agua, a 20°C, que puede convertirse en vapor, a 100°C, cuando se quema 1 m³ de 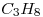 medidos en CNPT.
medidos en CNPT.
Ejercício 2
En un recipiente cerrado de 294 mL de capacidad se colocan 0,1054 mL de agua y se calienta hasta 65°C. Si la presión de vapor del agua, a 40°C, es 55,3 mmHg, calcular el % de agua que se conviertió en vapor.
Ejercício 3
Dada la siguiente reacción: 2A –> 4B, se encuentra experimentalmente que la constante de velocidad es 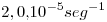 a 30°C.
Calcular el tiempo de vida media cuando la reacción se realiza a 50°C y se parte de una concentración de A=2M.
a 30°C.
Calcular el tiempo de vida media cuando la reacción se realiza a 50°C y se parte de una concentración de A=2M.
Ejercício 4
Indicar si las siguientes afirmaciones son verdaderas o falsas. Fundamentar la respuesta:
a)La constante “a” de van der Waals del amoníaco es mayor que la del hidrógeno.
b)El metano, 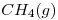 , difunde a una velocidad mayor que el oxígeno.
, difunde a una velocidad mayor que el oxígeno.
c)En una solución ideal de dos componentes volátiles A y B donde 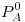 es menor que la
es menor que la 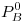 la presión total resulta siempre mayor que la presión de los componentes puros. Justificar graficamente.
la presión total resulta siempre mayor que la presión de los componentes puros. Justificar graficamente.
d)En la reacción 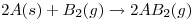 el entorno realiza trabajo sobre el sistema ya que el Δn es -1.
el entorno realiza trabajo sobre el sistema ya que el Δn es -1.
e)Si la temperatura de ebullición normal del compuesto X es mayor que la del compuesto Y esto implica que el compuesto X es más volátil.
Datos:
Ea=30 kJ/mol
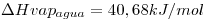
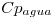 =4,18 J/g°C
=4,18 J/g°C
δagua=1g/mL
Ar H= 1
Ar O= 16
Ar C= 12
R=8,31 J/mol
