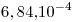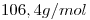Tabla de Contenidos
Examen (Parcial) - 63.02. Química I
Fecha: 1º Oportunidad - (2º Cuatrimestre) 2008
Esta página está incompleta; podés ayudar completando el material.
Enunciado
Punto I
Verdadero – Falso:
- Los ácidos débiles se pueden neutralizar con base fuerte y las soluciones son neutras.
- En una reacción endotérmica en el equilibrio se cumple que:
- La reacción química se ha detenido.
- Los reactivos se han consumido totalmente.
- A alta temperatura, mayor es el rendimiento de la reacción química.
 .
.
- Aquellas especies químicas que son más difíciles de reducir que el ión hidrógeno en condiciones estandar tienen un potencial de reducción estándar negativo.
- Cuanto más débil es un ácido, mayor es la hidrólisis de sus sales.
- Balancear la siguiente ecuación química por el método de ión electrón:

Punto II
- Molaridad de una solución
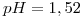
 si el pH de la solución es 6,21.
si el pH de la solución es 6,21. - Solubilidad sulfuro de plata en: agua,
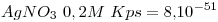
Punto III
- A una semicelda que contiene una solución preparada
 de nitrato de plata en agua hasta
de nitrato de plata en agua hasta  solución en la que se introduce un electrodo de plata se la conecta a otra semicelda de H de acidez desconocida, en la que
solución en la que se introduce un electrodo de plata se la conecta a otra semicelda de H de acidez desconocida, en la que  . Calcular pH.
. Calcular pH. - Al realizar la electrólisis de una solución acuosa de una sal
 con una
con una  durante 10hs, se depositaron en el cátodo
durante 10hs, se depositaron en el cátodo  de
de 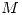 . Determinar
. Determinar 
Punto IV
En un recipiente de 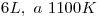 se coloca
se coloca 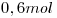 de Carbono,
de Carbono, 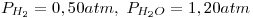 . Sistema en equilibrio,
. Sistema en equilibrio, 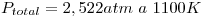 .
.
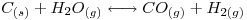
- Kp y Kc
- Porcentaje de carbono que reaccionó.
- Si se eleva la presión por variación de volumen. Explique hacia donde se va a desplazar la reacción para mantener el equilibrio.
Respuestas
Punto I
- F
- V, F, V, F
- V
- V
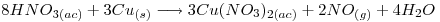
Punto II
Punto III
Punto IV
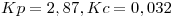
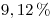
- Productos a reactivos.
Discusión
Si ves algo que te parece incorrecto en la resolución y no te animás a cambiarlo, dejá tu comentario acá.
Excepto donde se indique lo contrario, el contenido de esta wiki se autoriza bajo la siguiente licencia: CC Attribution-Noncommercial-Share Alike 3.0 Unported