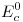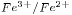Examen (Segundo Parcial) - 63.02. Química 1 - 27/06/2007
Cátedra: Lidia Pilar Sanchez
Fecha: 1ra Oportunidad - 1er Cuatrimestre 2007
Día: 27/06/2007
Punto I
1) Para la siguiente reacción, a 120ºC:
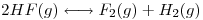
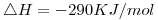
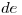
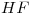
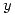

Cuando se coloca cierta masa de fluoruro de hidrógeno en un recipiente de paredes rígido de 30 dm3, a 120ºC, se liberan 44 KJ cuando se alcanza el equilibrio. Calcular (en el equilibrio):
a) La presión total en el recipiente
b) La masa de flúor gaseoso obtenida
c) Indique, fundamentando la respuesta, si a 500ºC aumenta o disminuye la producción de fluoruro gaseoso.
Punto II
2) a) Cuál es la concentración mínima, en % m/m, que debe tener 1 Kg de una solución de hidróxido de potasio, densidad 1,3 g/mL, para neutralizar 3,57 moles de ácido acético(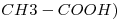 ?
?
b) Cuál es el pH de la solución final? Suponer que no hay variación de volumen.
c) Explique si para neutralizar 3,57 moles de ácido clorhídrico, la concentración de la solución de hidróxido de potasio debería ser mayor, menor o igual a la calculada en a)
Punto III
3) La oxidación de iones hierro (II) por los iones permanganato en medio ácido produce iones hierro (III), iones manganeso (II) y agua.
a) Iguale la ecuación química por el método ion-electrón e indique el agente oxidante y el agente reductor.
b) Si se arma una celda galvánica con la reacción del enunciado, calcular Ec cuando:
![<tex>[MnO_4^-]=5 \times 10^{-3}</tex> <tex>[MnO_4^-]=5 \times 10^{-3}</tex>](lib/plugins/latex/images/ca0bb772d863afd34a0fb2c636ba1f40d06a22e6_0.png) ;
; ![<tex>[Mn^{2+}]=3 \times 10^{-2}</tex> <tex>[Mn^{2+}]=3 \times 10^{-2}</tex>](lib/plugins/latex/images/2153251ee09d30f7cd8581602f4cd49b7923713c_0.png) ;
; ![<tex>[Fe^{2+}]=2 \times 10^{-2}</tex> <tex>[Fe^{2+}]=2 \times 10^{-2}</tex>](lib/plugins/latex/images/90a26a3094f83201896025ea857f71f9e1b94e22_0.png) ;
; ![<tex>[Fe^{3+}]=2 \times 10^{-4}</tex> <tex>[Fe^{3+}]=2 \times 10^{-4}</tex>](lib/plugins/latex/images/7b8fd56c867fe1aa12d36e5451e831318a51642c_0.png) ;
; 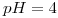
c) Escriba la notación convencional de la celda galvánica, indicando la polaridad de los electrodos.
d) A qué pH deja de funcionar la celda, si las demás concentraciones se mantienen constantes?
Punto IV
4) Indique Verdadero o Falso, justificando su respuesta:
a) …
b) El pH de una solución de ácido clorhídrico 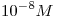 es
es 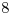 .
.
c) …
d) …
Datos
Los datos que se daban eran: 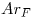 ;
; 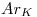 ;
; 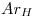 ;
; 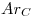 ;
; 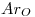 ;
; 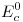
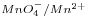 ;
;