Tabla de Contenidos
Exámen Parcial - 63.02. Química 1
Cátedra: Olezza
Fecha: 1ª Oportunidad - 2º Cuatrimestre 2002
Día: xx/10/2002
Esta página está incompleta; podés ayudar completando el material.
Enunciado
Punto A
Indicar si las siguientes aseveraciones son verdaderas o falsas y justificar brevemente
- Las moléculas de H2 difunden a mayor velocidad que las de He a 20°C y 1 atm.
- Las moléculas de un gas ideal chocan contra las paredes del recipiente modificando su velocidad
- Los coeficientes a y b de la ecuación de van del Waals para el Ne y el Kr presentan la característica de tener casi el mismo valor para a y distinto para b
- En una solución líquida de dos sustancias que presentan valores de la presión de vapor muy similares, la composición de la fase gaseosa es igual a la fase líquida.
- En una transformación química, constituida por un mecanismo de varias reacciones elementales, la velocidad de la reacción neta (la de la transformación) esta determinada por la reacción elemental de mayor orden total desde el punto de vista cinético.
- En todo proceso espontáneo la entropía del sistema aumenta y la del medio disminuye
- Comparando dos procesos, en los que ambos sistemas reciben igual cantidad de calor, aquel que esta a mayor temperatura experimentara un mayor incremento en su entropía
Problema 1
- Considerar que la mezcla etanol y 1-propanol se comporta idealmente a 36°C y está en equilibrio con su vapor. Si la fracción molar del etanol en la solución es de 0,62 calcular la fracción molar en la fase gaseosa a dicha temperatura. Datos:

- Sabiendo el calor de vaporización del etanol, calcular la temperatura de ebullición normal del mismo.

Problema 2
En el proceso de fermentación enzimático de un azúcar se midió la concentración inicial y se obtuvo 0.12M. Después de 10 horas se reduce a 0.06M y hasta 0.03M en 20 horas. ¿cuál es la constante de velocidad?
Problema 3
- La entalpía de combustión del ciclohexano liquido para dar agua gaseosa y dióxido de carbono es de –3655.4 KJ/mol. La entalpía de vaporización estandar del ciclo hexano y del agua son 33.4 y 44.016 KJ/mol respectivamente. Calcular la variación de entalpía de formación estándar del ciclo exano (l) y (g) aplicando las leyes de la termoquímica.
- Determinar Q, W, ΔH Y ΔE para la combustión completa de 252 g de ciclo exano a 25°C.
- Indicar si el
 y
y  van a ser mayor, menor o igual a cero para el item anterior.
van a ser mayor, menor o igual a cero para el item anterior.
Datos:

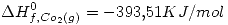
Discusión
Si ves algo que te parece incorrecto en la resolución y no te animás a cambiarlo, dejá tu comentario acá.
Excepto donde se indique lo contrario, el contenido de esta wiki se autoriza bajo la siguiente licencia: CC Attribution-Noncommercial-Share Alike 3.0 Unported
