Examen Parcial - 61.03. Química - 04 de Noviembre de 2005
Cátedra: Curso 13
Fecha: 2° Oportunidad - 2° Cuatrimestre 2005
Día: 04/11/2005
Enunciado
Punto I
a) Un kilogramo de  ocupa inicialmente un volumen de
ocupa inicialmente un volumen de 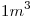 a una presión de
a una presión de 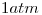 y evoluciona hasta alcanzar un estado final de
y evoluciona hasta alcanzar un estado final de  y
y  , primero isotérmicamente hasta la presión final y luego isobáricamente.
, primero isotérmicamente hasta la presión final y luego isobáricamente.
i. Dibuje la evolución en un diagrama PvsV.
ii. Determine  para la evolución completa.
para la evolución completa.

b) Cierto secadero procesa 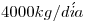 de producto húmedo, que ingresa al equipo a 100ºC con una humedad del 50%
de producto húmedo, que ingresa al equipo a 100ºC con una humedad del 50%  , y sale del mismo con una humedad del 15% y a la misma temperatura. Calcular el consumo de metano en kilogramos por día para suministrar el calor necesario, considerando que la combustión es completa. El rendimiento de la transferencia calórica es del 72%.
, y sale del mismo con una humedad del 15% y a la misma temperatura. Calcular el consumo de metano en kilogramos por día para suministrar el calor necesario, considerando que la combustión es completa. El rendimiento de la transferencia calórica es del 72%.
Punto II
a) Defina:
i) Presión de vapor
ii) Punto de ebullición
iii) Viscosidad
b) Explique por qué el carbono grafito conduce la electricidad, apelando a su estructura cristalinas. c) Explique, con base en las fuerzas intermoleculares, la alta solubilidad del formaldehído en agua. d) Explicar el concepto de curva de solubilidad. ¿Qué es una solución saturada, sobresaturada e insaturada? Dibujar un gráfico de una evolución seguida por una solución insaturada que se enfría hasta saturarse y que posteriormente se enfría 10ºC más.
Punto III
a) Para los siguientes compuestos escriba su fórmula desarrollada:
i) metilpentiléter
ii) fenol
iii) 1,3-exanodiol
iv) ácido exenóico
b) Ordene los compuestos mencionados en el ítem a) según presión de vapor creciente, justificando la respuesta. c) Escriba la fórmula desarrollada de un isómero de función de i), uno de posición de iii) y uno de cadena de iv), nombrándolos.
Punto IV
En un recipiente cerrado en el que se introducen  de A, se estudia la siguiente reacción:
de A, se estudia la siguiente reacción:

siendo  ,
, 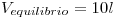 y
y  .
.
a) Determine el número de moles totales en el equilibrio.
b) Explique, justificando la respuesta, cómo varían y el número de moles de A si una vez alcanzado el equilibrio:
i. se aumenta la temperatura
ii. se aumenta la presión total
iii. se introduce un gas inerte
Resolución
