Examen Parcial - 61.03. Química - 6 de Julio de 2005
Cátedra: Curso 13
Fecha: 3° Oportunidad - 1° Cuatrimestre 2005
Día: 06/07/2005
Enunciado
Punto I
En un recipiente cerrado y rígido de  de capacidad, se inyectan
de capacidad, se inyectan  de
de 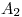 a la temperatura constante de
a la temperatura constante de  y se produce la siguiente reacción:
y se produce la siguiente reacción:

Calcule  hasta alcanzar el equilibrio.
hasta alcanzar el equilibrio.  .
.
Punto II
a) Escribir la fórmula desarrollada de un compuesto orgánico, un isómero de cadena, uno de posición y uno de función, todos con fórmula molecular  . Nómbrelos.
b) Explique en qué consiste y en qué casos se postula la hibridación
. Nómbrelos.
b) Explique en qué consiste y en qué casos se postula la hibridación  del átomo de carbono. Ejemplifique.
del átomo de carbono. Ejemplifique.
Punto III
a) Calcule el pH de una solución  de fenilamina (bencilamina) sabiendo que
de fenilamina (bencilamina) sabiendo que  . Resuelva planteando balances de masa y de carga.
b) Justifique hacia dónde se desplaza el equilibrio si a la solución anterior se agregan unas gotas de
. Resuelva planteando balances de masa y de carga.
b) Justifique hacia dónde se desplaza el equilibrio si a la solución anterior se agregan unas gotas de  . A temperatura constante ¿cómo se modifican
. A temperatura constante ¿cómo se modifican  y
y  con esta adición?
con esta adición?
Punto IV
Indique si las siguientes afirmaciones son verdaderas o falsas. Justifique.
a) En el agua pura, la concentración de  es
es  , a cualquier temperatura.
b) El
, a cualquier temperatura.
b) El  en estado sólido forma un sólido covalente, dado que el carbono y el oxígeno se enlazan mediante este tipo de unión.
c) A una dada presión, la temperatura de ebullición del metilpropiléter es mayor que la del 1-pentanol.
en estado sólido forma un sólido covalente, dado que el carbono y el oxígeno se enlazan mediante este tipo de unión.
c) A una dada presión, la temperatura de ebullición del metilpropiléter es mayor que la del 1-pentanol.
Punto V
a) Indicar tipo de sólido y propiedades del bromuro de litio. Mencione unidades en los nodos y tipo de enlace.
b) ¿Por qué, a pesar de tener un peso molecular similar, el agua y el metano tiene distinto estado de agregación a  y
y 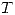 ambiente?
c) Dibuje a mano alzada una curva de solubilidad. Indique sobre el gráfico puntos correspondientes a solución saturada, no saturada y sobresaturada.
ambiente?
c) Dibuje a mano alzada una curva de solubilidad. Indique sobre el gráfico puntos correspondientes a solución saturada, no saturada y sobresaturada.
Punto VI
Se tiene un sistema heterogéneo obtenido a partir de  de agua y
de agua y  de un sólido A.
a) Calcule la composición de ambas fases en el sistema.
b) Calcule la molaridad de la solución resultante al evaporar
de un sólido A.
a) Calcule la composición de ambas fases en el sistema.
b) Calcule la molaridad de la solución resultante al evaporar  de agua.
de agua.
DATOS: Solubilidad de 
Resolución
