Examen Parcial - 61.03. Química - 03 de Junio de 2005
Cátedra: curso 10
Fecha: 2° Oportunidad - 1° Cuatrimestre 2005
Día: 03/06/2005
Enunciado
Punto I
Se disuelven 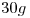 de ácido acético en
de ácido acético en 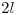 de agua.
de agua.
a) Sabiendo que 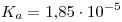 a la temperatura de trabajo, determine el pH de la solución y el grado de disociación. Plantee los balances de masa y de carga para resolver.
a la temperatura de trabajo, determine el pH de la solución y el grado de disociación. Plantee los balances de masa y de carga para resolver.
b) ¿Qué cantidad de hidróxido de sodio sólido debería agregarse para neutralizar todo el ácido?
c) En estas condiciones, el pH de la solución ¿será ácido, neutro o básico? Justifique.
d) Sabiendo que la solubilidad de la sal formada a la temperatura del ensayo, es de 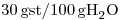 ¿qué cantidad de agua podrá evaporarse de la solución anterior antes de que aparezca el primer cristal?
¿qué cantidad de agua podrá evaporarse de la solución anterior antes de que aparezca el primer cristal? 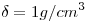
Punto II
- Explique qué significa:
I) Temperatura crítica.
II) 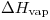 (molar).
(molar).
III) Capilaridad.
- Explique por qué el carbono grafito conduce la electricidad y el carbono diamante no, apelando a sus estructuras cristalinas.
- Dibuje el diagrama de fases de una sustancia que sublime a
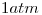 , que no pueda licuarse por encima de los
, que no pueda licuarse por encima de los 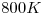 y que al pasar de sólido a líquido incremente su densidad.
y que al pasar de sólido a líquido incremente su densidad.
Punto III
Sean los siguientes compuestos:
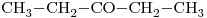
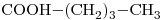
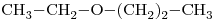
- Nómbrelos y escriba un isómero de cadena y otro de función de cada uno. Escriba también el nombre de todos los isómeros.
- ¿Cuál de ellos será el más viscoso y por qué?
- Obtenga el producto de la reacción entre el ii) y el etanol. Nómbrelo.
Punto IV
La combustión completa de 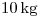 de
de 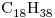 líquido se está llevando a cabo a
líquido se está llevando a cabo a 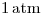 y
y 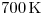 . El
. El 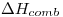 del compuesto es
del compuesto es 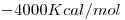 .
.
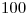 moles de gas ideal evolucionan según las siguientes etapas:
moles de gas ideal evolucionan según las siguientes etapas:
i) isocórica a 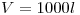 , desde
, desde 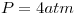 hasta
hasta 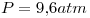 .
.
ii) isotérmica desde ese punto hasta la presión inicial.
iii) isobárica hasta cerrar la evolución.
El ciclo se describe en sentido horario. El calor necesario proviene de la combustión de una mezcla de metano (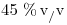 ) y etano. Considere que la transferencia de calor tiene una pérdida del
) y etano. Considere que la transferencia de calor tiene una pérdida del 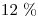 . Se pide:
. Se pide:
a) Escriba la ecuación termoquímica de la combustión, sabiendo que el agua finaliza en estado gaseoso.
b) Calcule 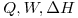 y
y  .
.
Si el calor generado por la combustión se utiliza para hacer evolucionar isotérmicamente un gas ideal a 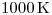 desde
desde 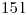 hasta
hasta 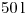 .
.
c) Grafique la evolución del gas en un diagrama 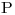 vs.
vs. 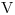 .
.
d) Determine los moles que evolucionan si el rendimiento del intercambio calórico es del 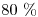 .
.
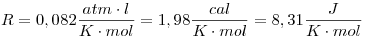
Resolución
