Tabla de Contenidos
Examen Final - 63.01. Química A - 16/12/2013
Cátedra: Todas
Fecha: Primer Oportunidad - Verano 2013
Día: 16/12/2015
Esta página está incompleta; podés ayudar completando el material.
Enunciado
Punto I
Se necesita obtener 10t de cobre apto para conductores eléctricos. El mineral del yacimiento (mena mixta de óxidos y sulfuros) contiene 2% en masa del metal y logra procesarse para obtener cobre impuro, apto para electrolizar, con una pérdida del 12%. Se pide:
- bosquejar la celda electrolítica a utilizar, mostrando la marcha de iones y electrones, las polaridades y los nombres de los electrodos;
- calcular la cantidad de mineral del yacimiento que deberá procesar y
- calcular la cantidad de moles de electrones que deberán circular, si el 10% se pierde en corrientes parásitas y reacciones secundarias.
Considerar que la pureza del cobre electrolítico es del 99,98% en masa. Datos: ACu = 63,546
Punto II
En un recipiente cerrado y rígido de 10L hay solamente 2 moles de la sustancia A gaseosa, que se descompone según:
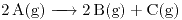
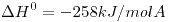
La reacción es elemental y transcurre a temperatura constante e igual a 150ºC. Al cabo de 1,70 minutos la cantidad de calor que el sistema ha entregado al entorno es de 70kJ. Se pide:
- la presión parcial de A transcurridos 1,70 minutos;
- el tiempo de vida media de la reacción y
- el valor de la velocidad específica de reacción a 150ºC
Resolución
Discusión
Si ves algo que te parece incorrecto en la resolución y no te animás a cambiarlo, dejá tu comentario acá.
Excepto donde se indique lo contrario, el contenido de esta wiki se autoriza bajo la siguiente licencia: CC Attribution-Noncommercial-Share Alike 3.0 Unported
