Examen Final - 63.01B. Química - 17/12/07
Cátedra:
Fecha: 1 Oportunidad - (2º Cuatrimestre Verano) 2007
Día: 17/12/2007
Enunciado
1) Complete la reacción 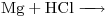 …….
…….
a) Considerando la espontaneidad de la reacción, diseñe una pila en donde esta reacción se obtenga como la suma de las reacciones de electrodo.
b) Diseñe un esquema de la pila indicando movimiento de electrones, polaridad, componentes, etc.. y la notación convencional de la misma.
c) Si se deja pasar una corriente de 3.574A valor medio durante 3hs cual sera el valor de la concentración de  al final de este pasaje.
al final de este pasaje.
d) ¿Qué volumen de hidróxido e Calcio se precisara para neutralizar el medio resultante en  ?.
?.
e) Hallar el máximo trabajo de comprensión-expansión a P= 1 atm, T:35°C.
2) Se tiene en un recipiente de 2l a 200°c 0.400 mol de  , 0.2 mol de
, 0.2 mol de  y se agrega también la cantidad de
y se agrega también la cantidad de 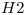 obtenida en el punto 1-c.
obtenida en el punto 1-c.
La reacción que aparece es la siguiente:

Si la concentración de  en equilibrio es de 0.124 M
en equilibrio es de 0.124 M
Calcular
A) Concentración en equilibrio de  ,
,  ,
, 
B) Presión de equilibrio.
3) Por una napa circula agua con  disuelto y el piso posee
disuelto y el piso posee  y
y 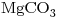 escribir las ecuaciones moleculares y iónicas del proceso que se desarrolla.
escribir las ecuaciones moleculares y iónicas del proceso que se desarrolla.
b) Si 100cm3 de agua poseen 1.2 mg de ion calcio, 6 mg de ion  , 4mg de
, 4mg de 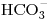 y cantidad suficiente de
y cantidad suficiente de  y
y  calcular la dureza total, permanente y temporaria.
calcular la dureza total, permanente y temporaria.
c)Se quiere conseguir un agua que no conduzca la corriente, explique el proceso de obtención de este agua con el uso de resinas, dibuje la instalación con formulas, etc…
4) (para los del 2007)
a) diferencias entre termoestables y termoplásticos, ejemplos, fórmulas, etc..
b) ¿Qué significa tener delta Gibbs = 0, <0, >0. ¿Cómo influye la T° en cada caso?
c) no me lo acuerdo, había una tabla con concentraciones de  y
y 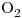 y te decía las velocidades iniciales, tenias que dar la ecuación de la velocidad de la reacción. Y después había que hallar K.
y te decía las velocidades iniciales, tenias que dar la ecuación de la velocidad de la reacción. Y después había que hallar K.
Discusión
Algunos esbozos de solución aquí
