Examen Final - 63.01. Química - 02 de marzo
Fecha: 4º Oportunidad - (2º Cuatrimestre Verano) 2007
Día: 02/03/2007
Enunciado
Punto I
Los puntos de fusión normal y de ebullición normal del Ar son 83,8 y 87,3 K respectivamente. Su punto triple se encuentra a 83,8 K y 0,8 atm. Dibuje un diagrama fases aproximado de sustancias y establezca si el Ar es sólido, líquido o gas en las siguientes condiciones:
(a) 0,9 atm y 90 K
(b) 0,7 atm y 80 K
(C)0,8 atm y 88 K
(d) 1,2 atm y 83,5 K
Punto II
Dos moles de gas ideal inicialmente a 330 K y 3,5 atm, se comprimen isotérmicamente. En este proceso la entropía del sistema disminuye en 25 J/K.
(a) Si el proceso se ha llevado a cabo de forma reversible, cuál ha sido el Q?
(b) Calcular la P final del gas y la variación de energía libre del proceso.
Punto III
Se dispone de:
- Solución concentrada de
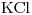
- Un electrodo de
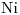 y otro de
y otro de 
- Soluciones 0,1 M de
 y
y 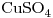
- Alambre conductor y dos cubas de vidrio.
(a) Calcule el potencial de ambos electrodos, en contacto con sus respectivas soluciones a T=298K.
(b) Halle la fem inicial de la pila que se puede construir con estos elementos y escriba su notación convencional.
(C) Cómo se modificará esta fem ante un aumento de temperatura? Justifique.
(d) Dibuje un esquema completo de la pila, incluyendo marcha de electrones y polaridad de los electrodos. Escriba las ecuaciones correspondientes a cada uno de ellos.
(e) Que corriente media ha circulado por el sistema, si al cabo de 1 hora la concentración de 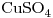 ha disminuido un 20%? Cuál será la concentración de
ha disminuido un 20%? Cuál será la concentración de  en la otra cuba al cabo de ese lapso?
en la otra cuba al cabo de ese lapso?
(f) Halle el trabajo máximo involucrado en el proceso.  y
y 
Punto IV
Una muestra de agua tiene las siguientes características: 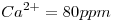 ,
, 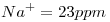 ,
,  ,
, 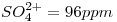 y
y  .
.
(a) Halle la cantidad de  que debe contener la muestra a asegurar sus efectos de electroneutralidad.
que debe contener la muestra a asegurar sus efectos de electroneutralidad.
(b) Determine la dureza total, temporaria y permanente.
(C) Si se somete la muestra a ebullición, qué reacción ocurrirá? Luego de este proceso, cuánto valen las durezas pedidas en b)?
(d) Realice el esquema de un ablandador de agua y explique su principio de funcionamiento.
Punto V
Usted disuelve 9,8g de ácido sulfúrico en un cierto volumen de agua.
(a) Cuál será ese volumen si se pretende generar una solución de 0,28N?
(b) Qué cantidad mínima de 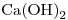 deberá agregarse a la solución anterior de modo de obtener un sistema heterogéneo? La solubilidad del sulfato de calcio a esa temperatura es de 1,14g/L.
deberá agregarse a la solución anterior de modo de obtener un sistema heterogéneo? La solubilidad del sulfato de calcio a esa temperatura es de 1,14g/L.

