Examen Final - 63.01. Química - 23-02-2007
Fecha: 3ª Oportunidad - (2º Cuatrimestre Verano) 2007
Día: 23/02/2007
Enunciado
Punto I
Dados los sistemas: Sulfato (VI) de sodio (ac), nitrato (V) de plata (ac), cloruro de sodio (fundido); disponiendo de electrodos inertes y de cobre, seleccionar el sistema y los electrodos para:
(a) obtener sodio por vía electrolítica
(b) descomponer el agua por vía electrolítica
(C) obtener cobre por vía electrolítica.
Desarrollar para cada punto esquema completo de la electrólisis (electrodos, polaridad, movimiento de cargas, etc.).
Datos
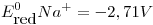 ,
, 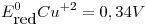 ,
, 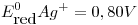 ,
, 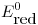

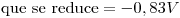 ,
, 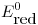

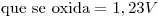
Punto II
(a) A qué se denomina corrosión electroquímica? Señalar causas que pueden originar diferencias de potencial dentro de una pieza metálica en contacto con un medio electrolítico.
(b) Ejemplificar con esquema y ecuaciones a un sistema sin protección y uno con método de protección catódica aplicada al mismo.
Punto III
(a) El agua de una napa, que contiene dióxido de carbono suelto, circula por un terreno que contiene  . Escriba la ecuación iónica y molecular de la reacción que se produce.
. Escriba la ecuación iónica y molecular de la reacción que se produce.
(b) Si una muestra de 100 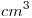 de agua contiene: 6 mg de ion calcio, 1,2 mg de ion magnesio, 7,32 mg de
de agua contiene: 6 mg de ion calcio, 1,2 mg de ion magnesio, 7,32 mg de 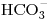 y cantidad suficiente de
y cantidad suficiente de  y
y  , calcular la dureza total, temporaria y permanente.
, calcular la dureza total, temporaria y permanente.
(C) El análisis de una muestra de agua indica que contiene sulfato (VI) de sodio, se requiere obtener agua desionizada a partir de la misma utilizando resinas de intercambio. Indicar esquema de la instalación y ecuaciones químicas correspondientes a este método.
Punto IV
Completar la reacción (correspondiente a un TP de laboratorio): 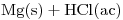 = …
= …
(a) Utilice la espontaneidad de esta reacción para obtener una pila en la cual esta reacción se obtenga por la suma de las reacciones de electrodo. Escriba las ecuaciones parciales de cada electrodo y la ecuación total.
(b) Dibuje la pila (Polaridad, movimiento de cargas, electrolitos, etc) e indique la notación convencional de la misma.
(C) Si se parte de HCl 1,2 M y la pila funciona 3 horas con una intensidad media de corriente de 3,574 A, calcule la concentración de HCl (ac) al cabo de este tiempo. Volumen = 0,5L
(d) Calcule (en Joule) el trabajo de expansión-compresión producido en la pila contra una presión constante de 1 atm a 35ºC.  ,
, 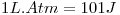 ,
, 
(e) Calcule el trabajo eléctrico máximo (en Joule) que se podría obtener con esta pila.

