63.01 Guía de ejercicios
Practica 1: Sistemas materiales
Liquidos
1)Definir tension superficial. ¿Cuál es la relación entre las fuerzas intermoleculares que existen en el liquido y la tensión superficial?
Las moleculas que se encuentran en el seno de un liquido son jaladas en todas direcciones por las fuerzas intermoleculares, no hay tendencia hacia una dirección unica. Sin embargo las moileculas de la superficie son jaladas hacia abajo y hacia los lados por otras moleculas, pero no hacia arriba de la superficie. En consecuencia, estas atracciones intermoleculares tienden a jalar esas moleculas hacia el liquido, lo que ocasiona que la superficie se tense como si fuera una pelicula elastica. La tension elastica es una medida de la fuerza elastica que existe en la superficie del liquido. La tension superficial es la cantidad de energia necesaria para estirar o aumentar la superficie de un liquido por unidad de area. Los liquidos que tienen fuerzas intermoleculares grandes también poseen tensiones superficiales altas.
2)A pesar de que el acero inoxidable es mucho más denso que el agua, una navaja de afeitar puede flotar en el agua. ¿Por que?
Una hoja de afeitar (o navaja) puede flotar en el agua porque el trabajo que ejerce la fuerza de gravedad sobre la navaja no es tan grande como la energia necesaria para dispersar la superficie del agua sobre la navaja.
3)Utilizar el agua y el mercurio como ejemplos para explicar la adhesión y la cohesion. Dibujar diagramas que muestren la acción capilar de : a)agua; b) mercurio La acción capilar es otro ejemplo de tensión superficial. El agua sube espontaneamente en un tubo capilar cuando una delgada pelicula de agua se adhiere a las paredes del tubo del vidrio. La tensión superficial del agua hace que esta pelicula sae contraiga y jale el agua hacia la parte superior del tubo. La capilaridad es el resultado de dos tipos de fuerzas . Una de ellas es la cohesion o atracción intermolecular entre moleculas semejantes (las moleculas de agua); la otra fuerza conocida como adhesión, es una atraccion entre moleculas distintas (como las de agua y del vidrio). Si la adhesion es más fuerte que la cohesion el contenido del tubo sera impulsado hacia arriba, este proceso continua hasta que la fuerza adhesiva se contrarresta por el peso del agua en el tubo. Sin embargo esta acción no es universal entre los liquidos. Por ejemplo para el mercurio la cohesión es mayor a la adhesion entre el mercurio y el vidrio, de manera que cuando un tubo capilar se sumerge en este liquido, lo que sucede es una depresion o disminución del nivel de mercurio, es decir la altura del liquido capilar enta por debajo de la superficie de mercurio
4) ¿Que es la viscosidad?¿Cuál es la relación entre la fuerzas intermoleculares que existen en el liquido y su viscosidad?
La viscosidad es una medida de la resistencia de los liquidos a fluir. Cuanto más viscoso es un liquido, más lento es su flujo. La viscosidad de un liquido suele disminuir con el aumento de la temperatura. Los liquidos con fuerzas intermoleculares fuertes son más viscosos que los que tiene fuerzas intermoleculares debiles
5)¿Por que la viscosidad de un liquido disminuye al aumentar su temperatura?
Porque aumenta la energía cinética de la sustancia, razón por la cual las moléculas de esta, tienen mas movimiento, entonces aumenta la fluidez de la sustancia.
6)Predecir que liquido tiene mayor tensión superficial, etanol (CH3-CH2-OH) o eter dimetilico (CH3-O-CH3)
Para predecir cual tiene más tensión superficial nos fijamos en la fuerzas intermoleculares, como el etanol puede formar puentes de hidrogeno sera el que tenga myor tension superficial.
7)Predecir la viscosidad del etilenglicol con respecto al etanol y a la glicerina
El liquido mas viscoso va ser la glicerina ya que puede formar 3 enlaces de puente de hidrogeno, después el etilenglicol que puede formar 2 enlace de puente de hidrogeno y por ultimo el eltanol que solo puede formar un solo enlace puente de hidrogeno.
8)Las presiones de vapor de equilibrio liquido-vapor de una serie de sustancia son
Sustancia Pva 20 ºC(mmHg) A 17,5 B 75,0 C 442,0
Justificar cual de las siguientes proposiciones es verdadera o falsa
a)En estado gaseoso, la sustancia más dificilmente licuable es la A.
b)Las fuerzas intermoleculares en C son mayores que en las otras sustancia.
c)El punto de ebullición de estas sustancias disminuye al aumentar la presion atmosferica
d)La presión de vapor de equilibrio de estas sustancias disminuye al aumentar el volumen del recipiente.
e)Dibujar hipoteticamente curvas de presión de vapor para cada una de estas sustancias sobre un mismo grafico.
8)a)Falsa
b)Falso, las fuerzas intermoleculares en C son menores que en las otras sustancias (la presion de vapor posee una relacion inversamente proporsional con las fuerzas intermoleculares
c)Falso, si se aumenta la presion atmosferica aumenta el punto de ebullicion (como en las ollas de presión)
d)Falsa
9)Cual de las siguientes opciones indica fuerzas de atraccion intermoleculares extremadamente debiles en un liquido:
a)un punto de ebullición__ muy elevado b)una presión de vapor__ muy alta
c)una temperatura critica__ muy alta d)un calor de vaporizacion__ muy alto
e)ninguna de estas
Fuandamentar las respuestas y explicar brevemente cada una de las propiedades subrayadas.
Practica 3: Termodinámica
Ejercicio 9
C6 H12 O6 (s) + 6O 2 (g) 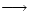 CO 2 (g) + 6H2 O(l)
CO 2 (g) + 6H2 O(l)  H0 = -3725cal/g glucosa
H0 = -3725cal/g glucosa
Después de ingerir ½ Kg. de helado de base acuosa que se encuentra a OºC ¿Cuántos gramos de glucosa se deben oxidar para igualar la temperatura al valor corporal de 37ºC?
DATOS:
Hfusión = 79,5 cal/g
Cp H2O (l)=1cal/gºC
1cal=4,18J
1º Hay un cambio de estado (Q Latente)
 H = m * H fusión = 500g * 79,5 cal/g = 39750 cal
H = m * H fusión = 500g * 79,5 cal/g = 39750 cal
2º Hay un cambio de Temperatura (Q Sensible)
 H = m * Cp *
H = m * Cp *  T = 500g * 1 cal/gºC * (37-0)ºC = 18500 cal
T = 500g * 1 cal/gºC * (37-0)ºC = 18500 cal
Sumo las  H = 39750+18500 = 58250cal
H = 39750+18500 = 58250cal
3725cal  1gr (dato)
58250cal
1gr (dato)
58250cal X = 15,63 gr
X = 15,63 gr
Ejercicio 10
NOTA: Para que de el resultado se cambió el  H0 = -395Kcal/mol por
H0 = -395Kcal/mol por  H0 = -395KJ/mol
H0 = -395KJ/mol
1º Rendimiento = 40%
40%  86,4 * 109 J
86,4 * 109 J
100%  X = 2,16 * 1011 J
X = 2,16 * 1011 J
395000J  1 Mol
2,16 * 1011 J
1 Mol
2,16 * 1011 J  X = 546835,4 Mol
X = 546835,4 Mol
2º Si 1 Mol de Carbono  12g
12g
546835,4 Mol  X = 6562025g = 6562Kg
X = 6562025g = 6562Kg
3º Pureza=85%
85%  6562 Kg
6562 Kg
100%  X = 7720 Kg
X = 7720 Kg
Ejercicio 11
 H0 reacción =
H0 reacción = 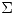 *n*
*n* H0(Productos) -
H0(Productos) -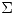 *n*
*n* H0(Reactivos)
H0(Reactivos)
C 2 H 5 OH(l) +3O 2(g)  3H 2O (l) + 2CO 2(g)
3H 2O (l) + 2CO 2(g)
 H= (3*(-287,1) + 2*(-393,5))-1)=-1370,6KJ/Mol
H= (3*(-287,1) + 2*(-393,5))-1)=-1370,6KJ/Mol
Ejercicio 12
Ejercicio 13
P es constante entonces  H=Q p =nC p
H=Q p =nC p  T= 10mol*7,11cal/(mol grado)*(200-25)ºC=12442,5cal=52KJ
T= 10mol*7,11cal/(mol grado)*(200-25)ºC=12442,5cal=52KJ
(1 caloría=4,18J)
 H=Q p = 52KJ
H=Q p = 52KJ
W=P  V= nRT (para gases)
V= nRT (para gases)
V inicial = 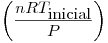 =(10*0,082*198)/5=32,47litros
=(10*0,082*198)/5=32,47litros
V final = 61,17 litros W=5atm*(61,17l-32,47l)= 143,5atml=14,5 KJ
(1atm*litro=1,01*10 -2
 E=Q-W=52KJ-14,5KJ=37,5KJ
E=Q-W=52KJ-14,5KJ=37,5KJ
Ejercicio 15
Una caldera para generación de vapor se alimienta con 200kg de fuel oil por día. Considerar al eicosano (C 20 H 42 ) Como hidrocarburo representativo del combustible.
datos: 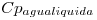 = 1kcal/kgºC ;
= 1kcal/kgºC ;
 = 9.73 kcal/mol ;
= 9.73 kcal/mol ;
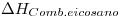 = -3384 kcal/mol
= -3384 kcal/mol
¿Cuál es el caudal de aire requerido para dicha combustión en m 3 CNPT/h?. (Considerar que se introduce un exceso de aire respecto de los valores estequiométricos, del 23% en volumen, a fin de asegurar una buena combustión).
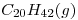 +
+ 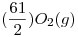

 +
+ 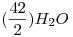

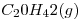 = 200kg
282g
= 200kg
282g 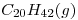
 1 mol
200000g
1 mol
200000g 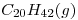
 X = 709.22 mol
X = 709.22 mol
Para que se consuman los 200 709.22 moles de eicosano se necesitan 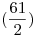 * 709.22 moles de
* 709.22 moles de 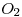 = 21631.21 mol
= 21631.21 mol 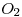
PV= nRT
V= 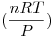
V=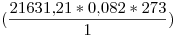 = 484236 litros
= 484236 litros
Como lo piden en 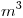 Volumen del oxígeno= 484.236
Volumen del oxígeno= 484.236 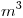
Para que haya una buena combustión se introduce un exceso del 23%
100%  484.236
484.236 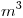
123%  595.61
595.61 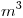
El aire está compuesto por un 21% de oxígeno
21% 
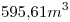
100%  X = 2836.24
X = 2836.24 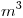
Como piden el caudal de aire por hora dividimos por 24  La Respuesta es 118,18
La Respuesta es 118,18 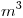 CNPT/h
CNPT/h
¿Cuál es el calor utilizable si las pérdidas por radiación son de 5%, y con los gases de chimenea se pierde un 3%?
Q=  H * n = 3384 kcal/mol * 709.22 moles (eicosano)= 2400000 kcal / día = 100000 kcal / hora
H * n = 3384 kcal/mol * 709.22 moles (eicosano)= 2400000 kcal / día = 100000 kcal / hora
Como se pierde en total un 8%
100% 100000 kcal
100000 kcal
92%  X= 92000 kcal
X= 92000 kcal
¿Cuál es la máxima producción de vapor de agua a 100ºC y 1 atm en kg/h? Considerar que el agua entra a la caldera a la temperatura de 90ºC.
Como el calor utilizable en el punto b era de 92000kcal, lo igualo a la suma del calor sensible y el calor latente del agua al llevarla de 90 a 100 grados.
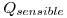 = nCp
= nCp t = n*1kcal/KgºC * (100ºC – 90ºC)= n*10kcal/kg
t = n*1kcal/KgºC * (100ºC – 90ºC)= n*10kcal/kg
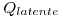 = n* 9.73 Kcal/mol=n*540.56 Kcal/Kg
= n* 9.73 Kcal/mol=n*540.56 Kcal/Kg
(1 mol de agua es igual a 0.018kg)
92000kcal = 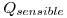 +
+ 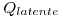
92000kcal = n*10kcal/kg + n*540.56 Kcal/Kg
167.10 kg = n

