63.01 Química - Ejercicios adicionales de Termodinámica y Equilibrio
Problema 1
Enunciado
A partir de un caudal de 500 kg/h de agua a 45ºC, se desea producir vapor saturado a 1 atm. Para ello se cuenta con eicosano como combustible( 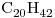 ). Se estima una perdida de calor del 15% con los gases de la chimenea.
). Se estima una perdida de calor del 15% con los gases de la chimenea.
- Calcular el caudal de combustible, en Kg/h, para operar la caldera.
- Calcular el caudal de aire requerido para la combustión, en
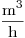 CNPT, si se introduce un exceso del 20% en volumen, para asegurar la combustión completa.
CNPT, si se introduce un exceso del 20% en volumen, para asegurar la combustión completa. - Escribir la ecuación termoquímica de la combustión, y calcular
 ,
,  ;
;  y W para la reacción química, a 1 atm y 25ºC.
y W para la reacción química, a 1 atm y 25ºC.
Datos:
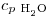 = 1 cal/gºC
= 1 cal/gºC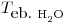 , a 4 atm = 144ºC
, a 4 atm = 144ºC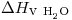 , a 144ºC = 9,73 kcal/mol
, a 144ºC = 9,73 kcal/mol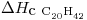 = -3384 kcal /mol
= -3384 kcal /mol- R = 1,98 cal/mol K
Respuestas
- 31,35 kg/h
- 433,7
Problema 2
Enunciado
Un secadero de yerba mate procesa 6.000 kg/día de producto, originalmente con 50% de humedad, el que debe salir con 23% de humedad. El secadero opera a temperatura constante de 60ºC y es alimentado con 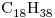 , cuya entalpía standard de combustión es
, cuya entalpía standard de combustión es 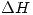 = -3220 kcal/mol. El rendimiento térmico de la instalación es del 76% y la entalpía standard de vaporización del agua a la temperatura de operación es 9,72 kcal/mol.
Calcular el consumo de combustible mensual, en kg.
= -3220 kcal/mol. El rendimiento térmico de la instalación es del 76% y la entalpía standard de vaporización del agua a la temperatura de operación es 9,72 kcal/mol.
Calcular el consumo de combustible mensual, en kg.
Respuesta
3537,73 kg
Problema 3
Enunciado
Cuando se hace pasar etanol (g) sobre un catalizador a 400 K ocurre la deshidratación del mismo con formación de etileno (g). A la temperatura indicada y a 1 atm reacciona el 90.6% del etanol introducido en el reactor. La deshidratación de un mol de etanol aumenta la energía interna del sistema en 84,156 kJ.
- Escribir la ecuación termoquímica correspondiente.
- Calcular
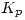 en las condiciones dadas.
en las condiciones dadas. - Calcular la composición del sistema final cuando la deshidratación de etanol se realiza, en las condiciones indicadas, con la energía que libera la combustión de 4 g de grafito.
Datos:
 de la combustión del grafito = - 393,51 kJ/mol
de la combustión del grafito = - 393,51 kJ/mol
Respuesta

- 9,64
- 0.16 moles de etanol ; 1.56 moles eteno ; 1.56 moles agua
Problema 4
Enunciado
En un reactor, que opera a 20 atm y 25ºC, se colocaron 30 moles de un gas 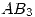 el que se descompuso de acuerdo con la reacción:
el que se descompuso de acuerdo con la reacción:
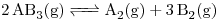 .
Al llegar al estado de equilibrio, el sistema había realizado un trabajo mecánico de 59230 J.
.
Al llegar al estado de equilibrio, el sistema había realizado un trabajo mecánico de 59230 J.
- Calcular la composición final alcanzada por el sistema en mol/L, y
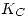 .
. - Calcular el calor intercambiado con el medio.
- Calcular la variación de energía interna que experimenta el sistema.
Datos:
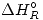 = - 5,43 Kcal/mol.
= - 5,43 Kcal/mol.- R = 8,314 J/mol.K = 0,082 L.atm/mol.K
Respuestas
![<tex>[ \ce{AB3}]</tex> <tex>[ \ce{AB3}]</tex>](lib/plugins/latex/images/ca2348bbbf9f01934e6734b42e9a001ddf49a375_0.png) = 0.0926 M ;
= 0.0926 M ; ![<tex>[\ce{A2}]</tex> <tex>[\ce{A2}]</tex>](lib/plugins/latex/images/7d08f5a1d5239817438e5651d659e4bac211733c_0.png) = 0.181 M ;
= 0.181 M ; ![<tex>[\ce{B2}]</tex> <tex>[\ce{B2}]</tex>](lib/plugins/latex/images/532037c2ec3bc51df18ffa719aec3daa65c23798_0.png) = 0.54 M
= 0.54 M- 542.46 kJ
- -601.69 kJ
