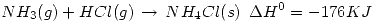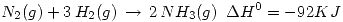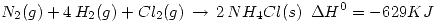Tabla de Contenidos
Examen Parcial - 63.02. Química I
Cátedra: Olezza
Fecha: 1ª Oportunidad - 1er Cuatrimestre 2006
Día: 24/05/2006
Esta página está incompleta; podés ayudar completando el material.
Enunciado
Punto 2
Parte a) Calcular el calor de la siguiente reacción: 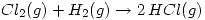 Sabiendo que:
Sabiendo que:
Parte b) Para la reacción 3) calcular la variación de energía interna a 25°C
Punto 3
Se tienen para la reacción 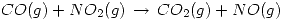 los siguientes datos sobre cuatro experiencias realizadas a temperatura constante.
los siguientes datos sobre cuatro experiencias realizadas a temperatura constante.
| N° de experiencia | [ ] (mol/L) ] (mol/L) | [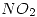 ] (mol/L) ] (mol/L) | Vi (mol/Lhora) |
|---|---|---|---|
| 1 | 5.0*10-4 | 0.36*10-4 | 3.4*10-8 |
| 2 | 5.0*10-4 | 0.18*10-4 | 1.7*10-8 |
| 3 | 1.0*10-3 | 0.36*10-4 | 6.8*10-8 |
| 4 | 1.5*10-3 | 0.72*10-4 | ? |
- Escribir la ley de velocidad
- Calcular la constante de velocidad (K)
- Hallar la velocidad inicial en el experimento 4
4) El antraceno tiene una fórmula empírica 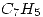 . Para determinar su fórmula molecular se disuelven 0.507g en 30.0g de benceno. El punto de ebullición del benceno es 80.1°C y la solución tiene un punto de ebullición 80.34°C ¿Cuál es la fórmula molecular del antraceno?
Ke= 2.53°C/m
. Para determinar su fórmula molecular se disuelven 0.507g en 30.0g de benceno. El punto de ebullición del benceno es 80.1°C y la solución tiene un punto de ebullición 80.34°C ¿Cuál es la fórmula molecular del antraceno?
Ke= 2.53°C/m
Resolución
Los resultados son:
2)a)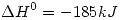
b)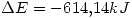
3)b)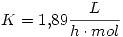
a)![<tex>V=1.89[CO]^1[NO_2]^2</tex> <tex>V=1.89[CO]^1[NO_2]^2</tex>](lib/plugins/latex/images/f59ef41c09b361368687e312fa14e5f50b3590da_0.png)
c)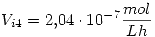
4)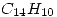
Discusión
Si ves algo que te parece incorrecto en la resolución y no te animás a cambiarlo, dejá tu comentario acá.